スリー・ディー・マトリックスの平均年収
スリー・ディー・マトリックスとは
| 企業名 | スリー・ディー・マトリックス |
|---|---|
| 本社所在地 | 千代田区麹町三丁目2番4号 |
| 売上高 | 21.3億円 |
| 社員数 | 18人 |
| 平均年収 | 866万円 |
| 推定初任給 | 38万円 |
| 年収偏差値 | 70.6 |
| 平均年齢 | 46.8歳 |
| 平均勤続年数 | 1.3年 |
有価証券報告書によるとスリー・ディー・マトリックスの事業内容は次の通りです。
当社グループは、当社及び連結子会社9社で構成され、MITより自己組織化ペプチド技術に係る特許の独占的実施権の許諾を受けて、同技術を基盤技術とした製品の研究開発・製造・販売を実施することを目的とした医療製品事業を行っております。
当社グループは、医療製品事業の単一セグメントであり、医療製品開発・販売で構成されております。その内容は以下のとおりです。
(医療製品事業の構成)
区分 | 内容 |
医療製品開発・販売 | 自己組織化ペプチド技術を基盤技術として外科領域・組織再生領域・DDS領域において医療機器及び医薬品の研究開発を行う事業です。 主要な開発パイプラインとしては、外科領域では吸収性局所止血材、粘膜隆起材、後出血予防材、癒着防止材を有しており、組織再生領域では創傷治癒材、歯槽骨再建材、DDS領域では核酸医薬等のためのDDSを有しています。 |
(1)自己組織化ペプチド技術の特徴
当社グループの基盤技術となっている自己組織化ペプチド(*)のうち最も開発が先行し複数の製品を上市しているペプチドRADA16は、体を構成するアミノ酸(*)であるアルギニン(R)(*)、アラニン(A)(*)、アスパラギン酸(D)(*)からなる(RADA)の繰り返し配列である16残基のペプチド(*)であり、このペプチドを溶解した水溶液はpH(*)が酸性から中性になると速やかにゲル化(*)する性質を有しています。具体的には、分子同士が繊維状に結合(自己組織化)してナノファイバーを形成し、そのナノファイバーが絡み合うことでゲル化します。形成されたゲルは生体内で細胞が培養される環境に近く、コラーゲン等の細胞外マトリックス(*)に似た網目構造をしています。
自己組織化ペプチドは、生物由来の原材料を含まず化学合成により生産されることから、生物由来の原材料から生じるウイルス等の感染や未知の成分の混入の可能性がないため安全性が高く、ほぼ均一の品質で大量生産が可能な点が特長として挙げられます。自己組織化ペプチドは、これまでに実施したADME試験(*)において、特定の臓器に蓄積されることなく、生体内のタンパク質と同様にタンパク質分解酵素(*)により分解され、30日程度で体外に排出されることが確認されています。
(2)医療製品開発
医療製品開発は、自己組織化ペプチド技術を基盤技術として外科領域、組織再生領域、DDS(*)領域において医療機器及び医薬品の開発を行う事業です。
主要な開発パイプラインのうち、外科領域では吸収性局所止血材・粘膜隆起材・癒着防止材、組織再生領域では歯槽骨再建材・創傷治癒材についてはそのいずれについても、医療機器として自ら開発し製造販売承認を取得する方針ですが、地域によっては薬事規制、市場動向、当社グループのリソース等を勘案して現地企業等と提携することでの製品化も実施していく方針です。販売についても製品、地域に応じて、代理店を通じての直接販売及び販売パートナーに対する販売権許諾の双方の戦略を適切に選択しあるいは組み合わせていく方針です。DDS領域では、自己組織化ペプチドを薬剤の担体(*)とし、各薬剤と組み合わせた製品化に向け取り組んでおりますが、医薬品として開発することとなる可能性が高く当社独自で薬剤や治療物質について技術を取得するには時間を要することからも、製薬会社等に技術供与(ライセンス)を行うことによりロイヤリティー等のライセンス収入の獲得を目指してまいります。
その他当社グループでは、大学等の研究機関とのMTA契約(*)及び共同研究契約に基づく共同研究によって、自己組織化ペプチドを基盤とした応用技術の獲得に取り組んでいます。
A 各領域及び各パイプラインの概要
(A) 外科領域
当社は、外科領域において、吸収性局所止血材、粘膜隆起材、癒着防止材の開発パイプラインを有しています。
a)吸収性局所止血材
当社は、自己組織化ペプチドであるRADA16を基に、出血部に塗布して用いる外科手術用の吸収性局所止血材(開発コード:TDM-621)(以下「TDM-621」という。)の開発を進めています。RADA16の水溶液は、血液等の体液と接触するとpHが中性化され、自己組織化してナノファイバーを形成しゲル化します。ゲルは体組織との接触面を隙間なく被覆し、被膜が形成されて表面皮膜及び血管浅部を物理的に閉鎖し、血管深部では血液凝固が生じることで止血されます。
<自己組織化ペプチドのゲル化形成>
自己組織化前のペプチド分子
<止血方法 概略図>
TDM-621は、RADA16の水溶液をシリンジに無菌充填したプレフィルドシリンジ(*)形態で、ブリスター包装(*)された製品であるため、手術現場では、パックを開封してすぐに使用することが可能であること、使用前の調製の必要がないなど適用量が調整しやすく操作性に優れていることといった特長を有しています。また、澄明な液体形状であることから術野を妨げることがなく、カテーテルや組織の狭部への適用も容易です。
既存の止血剤製品群(*)は、糊状・シート状・粉末状等の形状がありますが、主として糊のように機能して接着することにより止血効果を得るものであるのに対し、TDM-621は物理的に表面皮膜及び血管浅部を閉鎖して止血するものであるため、既存製品と異なり接着による待ち時間、圧迫による圧着時間を短縮することが可能です。また、既存製品は、一度組織に接着すると除去が困難であるのに対し、TDM-621は、余剰部分を生理食塩水により洗い流すことで容易に除去することができます。既存製品の多くは、フィブリノゲン(*)等の人や動物の血液から生成又は動物の皮膚から生成したコラーゲン等を原材料としており、これらの原材料から生じるウイルス感染等のリスクは完全には否定できないことから、生物由来製品又は特定生物由来製品として指定されており、医療現場においては、① 患者(又はその家族)への適切な説明、② 使用記録の作成と保管、③ 感染症等情報の報告等における管理体制の厳格化が要請されます。これに対してPurastatは、生体内に存在するアミノ酸を化学的に合成したもので生物由来の細胞。組織等を原材料として含まないため、これらの原材料から生じるウイルス等の感染や未知の成分の混入によるリスクがありません。また、生物由来製品又は特定生物由来製品に求められるプロセスが不要なため、TDM-621は患者と医療従事者の負担の軽減にも貢献できるものと考えられます。
(研究開発の状況)
TDM-621の日本での製造販売承認については、2019年10月に消化器内視鏡治療における漏出性出血に対する止血を対象として製造販売承認申請を行い、2020年7月に製造販売承認を取得し、2021年12月からは保険適用が開始されました(製品名はピュアスタット)。
また、当社は、TDM-621の海外展開に向け開発を進めております。欧州においては、2014年1月にCEマーキングの指令適合について第三者認証機関から認証を受け、EU加盟国において製品販売を開始しております。アジア・オセアニア・南米地域の主要国では、CEマーキングを活用し、登録承認を取得し、製品販売を開始しております。米国においてはまず消化器内視鏡の領域において、510(k) (*)のプロセスにて承認申請を行い、2021年6月に承認を取得し、欧州において製造を開始しており、2023年4月期からの販売を予定しております。
b)粘膜隆起材
当社は、自己組織化ペプチドを基に、消化器内視鏡治療による胃癌や食道癌等の粘膜切除術や粘膜下層剥離術(*)において、腫瘍部位の粘膜隆起を形成する内視鏡用粘膜下注入材(*)(開発コード: TDM-644)(以下「TDM-644」という。)の開発を進めています。胃や食道等の早期癌治療において行われる内視鏡による粘膜切除術や粘膜下層剥離術では、粘膜下層に生理食塩水や内視鏡用粘膜下注入材を病変部の粘膜下層に注入し、病変部を隆起させ、隆起させた根元部分に細いワイヤーをかけて締めたうえで高周波を流して焼き切り(内視鏡的粘膜切除術)、又は隆起させた病変部を粘膜下層の深さで電気メスにより引き剥がし(内視鏡的粘膜下層剥離術)、病変部を取り除きます。この病変部を隆起させるために用いられる内視鏡用粘膜下注入材として開発しているのがTDM-644であり、血液等の体液と接触することで中性化しゲル化する特徴から、必要な隆起を形成するとともに、副次的には止血効果も有することが動物実験により確認されています。
<粘膜隆起方法 概略図>
(研究開発の状況)
本製品は治験を必要としない改良医療機器での製造販売承認を申請し、2020年12月に2021年5月に製造販売承認を取得しております。2021年12月には販売用製品の製造を開始しました。現在保険適用に向けた準備を進めており、今後は早期に止血材とのクロスセルができる体制を構築してまいります。
c)後出血予防材
当社グループにおいては、TDM-621について治療後に起こる後出血について医療機器としての承認を得るべく開発を進めています。治療時に後出血が生じると、再手術が必要となることから患者及び医療機関双方の負担が大きく、強いニーズがあります。消化器内視鏡治療における出血はおおよそ5%程度であるのに対し、治療後に後出血が懸念されるリスクの高い患者・手技はおおよそ30%あるとされており、本適応の追加により当社製品が獲得可能な市場は数倍に拡大する可能性があります。
(研究開発の状況)
欧州においては、消化器内視鏡治療時に生じる後出血予防効果に関して、2018年12月に適応追加が承認されております。また、オーストラリアにおいても後出血予防効果に関して、2019年9月に適応追加が承認されました。さらに、米国においては2021年6月に止血材の承認と合わせて後出血予防の適応も同時に承認を受けております。
d)癒着防止材
RADA16について、止血材だけではなく、癒着防止材、創傷治癒材としての開発も進めております。米国においては耳鼻咽喉科領域においてすでに販売承認を受け、販売を介しておりますが、今後、はるかに大きな市場が存在する産婦人科等の領域に適応拡大をすべく、日本と欧州双方で医師主導治験の準備を進めております。
(研究開発の状況)
米国においては2019年4月に耳鼻咽喉科領域において、FDAより癒着防止材兼止血材「PuraSinus」の販売承認を受けております。本製品は、癒着防止、止血、創傷治癒を同時に行える現状唯一の製品であることから、鼻甲介切除術や鼻中隔形成術等において高い臨床的価値を提供でき得るものと期待しております。特に術後のパッキング(鼻に詰め物をする処置)は患者のQOLを著しく悪化させているといわれておりますが、当社製品によってパッキングを極力減らすことが可能となり、患者のQOLを重視する米国市場では強いニーズが期待できます。
e )次世代止血材
RADA16とは異なる、当社が独自に開発し特許を保有する新規ペプチド配列を用いた開発品です。現在の止血材より止血効果に優れ、原価を大幅に削減できる等の優位性があると考えられることから、将来的に主力製品として市場に供給すべく開発を進めております。
(研究開発の状況)
欧州においては、2021年5月に治験計画届の承認がなされ、2021年7月より脳神経外科を対象とした治験を開始しております。本試験開始前の探索的臨床試験については、2021年12月に全ての患者への投与が完了し、安全性が確認されたことから、本試験への移行が開始されました。
f)血管塞栓材
当社は、自己組織化ペプチドであるRADA16を基に、肝動脈塞栓術及び子宮動脈塞栓術における塞栓物として用いるための血管内塞栓促進用補綴材(*)(開発コード:TDM-631)(以下「TDM-631」という。)の研究開発を進めています。肝臓癌や子宮筋腫に対する肝動脈塞栓術及び子宮動脈塞栓術では、カテーテルを通じて動脈内に塞栓物を注入し、血管内腔を物理的に塞栓することで、腫瘍の栄養血管である動脈を塞いで腫瘍への栄養を絶ち、腫瘍を死滅させます。TDM-631は、血液と接触するとゲル化するため、カテーテルから動脈内に注入されると血管内腔を塞ぐことが可能であり、当社は新たな塞栓物としてTDM-631の開発を進めております。
(研究開発の状況)
当社は、前臨床試験により、TDM-631を造影剤に溶解しカテーテルを通して血管内に注入するとゲル化することや、ゲル化したTDM-631はX線カメラにより視認可能なことを確認しております。また、TDM-631の生体内における血管塞栓効果をみるために、動物モデルを用いた実験を行っております。
(B) 組織再生領域
自己組織化ペプチドは細胞の増殖を支える細胞外マトリックスに似た物理構造を有することから、当社グループでは、組織再生領域において創傷治癒材、歯槽骨再建材を開発パイプラインとして有しております。また当社グループは、当該パイプライン以外に、歯槽骨以外の骨の再建、軟骨・腱の再生、心筋の再生等に関する研究を行っております。
a)直腸における粘膜炎の創傷治癒材
当社グループは、直腸における粘膜炎により損傷した粘膜組織に塗布することで粘膜組織上に保護膜を形成し、二次炎症の防止や痛みの軽減に加え創傷治癒に最適な湿潤環境を維持する創傷治癒材を開発しております。
(研究開発の状況)
米国において、2022年4月に直腸の粘膜炎の創傷治癒に対する501(k)の承認を取得いたしました。この承認は直腸の粘膜炎などの治癒に幅広く使える可能性がある承認であり、止血材よりさらに付加価値の高い製品としての販売が可能となります。例えば一つの適応事例としての放射線性直腸炎は、前立腺がんや子宮がん等への放射線療法に起因する副作用で、大腸粘膜の炎症を高頻度で引き起こします。また、2割程度の患者は慢性的な下血、頻繁な排便、激しい腹痛等の晩期障害に悩まされており、有効な治療法の確立が望まれております。
この領域で早急に成長を蓄積し、さらに巨大な市場である炎症性腸疾患(IBD)への適応拡大を進めてまいります。IBDは消化管の難治性炎症で、原因不明で一度発症すると再燃と寛解を繰り返す難治性疾患であり、日本においては特定疾患として指定されています。IBDはグローバルに数兆円の顕在市場が存在します。現在日米欧にて複数の医師主導治験を計画し、早期にPOC(Proof Of Concept)を取得したい考えであります。
b)創傷治癒材
当社グループは、皮膚(表皮、表皮・真皮)からの出血を迅速に止血する局所止血材、皮膚の創傷部の創傷治癒に適切な湿潤環境を維持する、創傷治癒材(開発コード:TDM-511)(以下「TDM-511」という。)を開発しております。
(研究開発の状況)
2014年10月に医療機器として市販前届510(k)を米国FDAに申請し、切り傷、すりむき、創傷、I度熱傷及び医師指導の下での表皮から真皮層までの皮膚創傷(圧迫による褥瘡、下肢潰瘍、糖尿性病性潰瘍、手術痕等)を適用として2015年2月に販売承認を得ました。創傷治癒材としての活用に加え、他薬剤とのコンビネーションによる治療効果の増大が期待できることから、熱傷治療、皮膚がん治療などへの応用研究を進めていく計画です。また、米国において巨大な市場である美容整形分野にアクセスするために、現在米国FDAに対して適応の拡大を申請しております。
c)歯槽骨再建材
当社グループは、歯周病による歯槽骨の退行で歯が脱落した場合等に、インプラント術前にインプラント固定に充分な骨量を確保するために行う歯槽骨再建術において、骨再生のための足場材(*)となる製品(開発コード:TDM-711)(以下「TDM-711」という。)の開発を行っています。
ゲル化された自己組織化ペプチドは、ナノファイバーによる3次元構造が維持され、生体内で細胞が増殖する環境に近く、生体組織の再生をサポートする特性を有しています。TDM-711は、骨量不足箇所に充填されると、かかる特性により足場材として骨再生を促進します。米国でのインプラント治療における歯槽骨再建術では、代替骨を用いる施術も少なくなく、自家骨(*)や他家骨(*)、人工骨を用いた再建術が行われていますが、当社グループは、他家骨や人工骨を用いた再建術において、その生着を高めるためにTDM-711を用いることの開発を進めております。
(研究開発の状況)
当社グループは、GLP(*)下において歯槽骨に欠損がある状態でのTDM-711の有効性の確認試験を実施し、通常の欠損群に比べ有意な骨再生が認められたため、その後も研究開発を進めてまいりました。当社グループは、TDM-711につき、2012年2月には、米国ハーバード大学の医学部・歯学部の付属研究所であるフォーサイス・インスティテュート(Forsyth Institute)において、臨床試験を開始し、プロトコルで規定した15症例の施術および経過観察が完了しております。骨再生に有効なデータを得ておりますが、プロトコルに改善の余地があったため、2018年4月期に症例を追加して現在も臨床試験を継続しており、今後も製品化に向けた開発を進めてまいります。
(C) DDS領域
当社は、DDS領域において、自己組織化ペプチドをDDSにおける薬剤や治療物質のキャリア担体として活用するための研究開発を行っており、bFGF(*)・PDGF(*)等のタンパク質の徐放においても複数の有効性試験を実施しております。中でも、ハイドロゲルを形成する自己組織化ペプチドとは異なり界面活性(*)作用を持つペプチド(A6K(*))については、溶液中でナノチューブを形成する性質を有するため、当社は、癌細胞へのsiRNA(*)の導入試験において、かかる性質を活かし、ナノチューブに内包された形で癌細胞膜透過性をもたらし、導入効率を高めていく研究を行っております。
(研究開発の状況)
国立がん研究センターとの「RPN2標的核酸医薬によるトリプルネガティブ乳がん治療」共同プロジェクトにおいて、界面活性剤様ペプチドA6Kを核酸医薬のDDSとして提供しておりました。当社は、国立がん研究センターと共同でがん幹細胞に対する治療薬や診断方法の特許を取得しており、同分野や関連分野の共同研究/共同開発に向けた取り組みを進めております。
広島大学との共同プロジェクトにおいても、悪性胸膜中皮腫を対象疾患とする革新的抗腫瘍核酸医薬にA6Kを提供し共同開発を進めておりましたが、広島大学の田原栄俊教授により新たに設立された株式会社PURMX Therapeuticsが今後の製品開発を主導することとなりました。当社も同社株式を一部取得し、今後も引き続き共同で製品開発を進めてまいります。2022年1月には、医師主導治験(第I相)において第一症例の組み入れが実施され、臨床試験が開始されております。
核酸医薬へのDDSとして当社製品がヒト臨床で使用されるのはこれで2件目となります。今後の核酸医薬の広まりとともに、当社の技術が核酸のデリバリーのオプションとして更なる広がりをみせる可能性が出てきております。
B 医療製品の開発プロセス
当社グループが自社による開発や製造販売承認取得を目指している医療製品の多くは、医療機器に分類されます。
新たに医療機器や医薬品を開発する場合、その開発プロセスは、基礎研究、前臨床試験、臨床試験、製造販売承認申請という基本的な流れは共通ですが、医薬品の場合には臨床試験が多段階に設定されており、一般に試験を行うことが要求される対象例や症例数が多く、医薬品の開発プロセスは長期に亘ります。
医薬品の開発プロセスでは、臨床試験の試験相が第Ⅲ相まで(第Ⅰ相・第Ⅱ相で少数の健常人や患者に対して投与し安全性や有効性の評価を行い、第Ⅲ相で多数の患者に投与し、安全性や有効性の確認・実証を行う)に分かれるのに対し、当社グループが開発している医療機器では1つの相で比較的短期間に臨床試験が実施されます。
当社グループでは、現在、外科領域における吸収性局所止血材・粘膜隆起材・癒着防止材、組織再生領域における創傷治癒材・歯槽骨再建材を医療機器として開発し、当社グループ自ら製造販売承認を取得しています。なお、DDS領域における自己組織化ペプチド薬剤の担体については、医薬品としての開発となる可能性が高いこと、また、当社独自で薬剤や治療物質についての技術を取得するには時間を要することなどから、主に大手製薬企業への技術供与(ライセンス)を行うことでロイヤリティー等のライセンス収入の獲得を目指します。
当社の医療機器の研究開発プロセスの概要は以下のとおりです。
| 各プロセス | 内容 |
① | 基礎研究 | 当社技術が適用可能で医療機器として開発可能なアプリケーションの探索及び製品スペックの最適化を行う。 |
② | 前臨床試験 | 医療機器としての条件を満たす安全性、有効性を動物実験により検証を行う。 |
③ | 臨床試験 | 患者に対する医療機器の安全性、有効性について検証を行う。 |
④ | 製造販売承認申請 | 厚生労働省/PMDA、米国のFDA等の各国の許認可審査機関へ製造販売承認の申請を行う。 |
⑤ | 製造販売承認取得 | 厚生労働省/PMDAや各国の許認可審査機関から製造販売承認を得る。 |
⑥ | 保険収載 | 各健康保険の適用が可能な償還価格(*)を得る。 |
⑦ | 上市 | 医療機器製品として製造及び販売を行う。 |
当社グループでの医療製品開発における、主要なパイプラインの進捗状況は以下のとおりです。
(主要なパイプライン開発の状況)
(注)1 吸収性局所止血材
欧州:2014年1月にCEマーキング指令適合を受け2015年4月期に製品販売を開始。
日本:2020年7月に製造販売承認を取得、2022年4月期に製品販売を開始。
米国:2021年6月に510(k)での承認を取得。
韓国:CEマーキングでの製品登録申請済、2023年4月期での承認取得及び製品販売開始を予定。
南米地域(ブラジル、メキシコ、コロンビア等):2016年4月期に各国での製品登録が完了。2017年4月期より製品販売を開始。
他アジア・オセアニア地域:香港、シンガポール、インドネシア、マレーシア、ブルネイ、オーストラリアタイの各国にて2017年4月期に製品販売を開始。
2 癒着防止材
米国において2019年4月に耳鼻咽喉科領域においてFDA(米国食品医薬品局)へ市販前届510(k)申請による承認取得。適応拡大を申請中。
3 歯槽骨再建材
米国において2012年2月に臨床試験を開始、2018年4月期に症例を追加し継続中。
4 創傷治癒材
2014年10月にFDA(米国食品医薬品局)へ市販前届510(k)を申請、2015年2月に同承認を取得。2022年4月に直腸における粘膜炎についてFDAより承認を取得。
5 DDS領域
DDS(ドラッグ・デリバリー・システム)領域において当社ペプチドを医薬品等のキャリアとする大学等の研究機関との共同開発を行い、当社単独での事業化ではなく大手製薬企業への技術供与(ライセンス)を目標。
C 医療製品開発の事業体制
当社グループでは、小規模・少人数の組織体制で医療製品開発を効率的に進めるため、外部機関を有効に活用して事業を遂行しています。研究開発においては、当社グループがMITから独占的実施権を得ている自己組織化ペプチド技術を基盤技術として、大学・研究機関等とMTA契約又は共同研究契約を締結し共同研究等によって応用技術の獲得に取り組んでいます。
当社グループにおける基本的な医療製品事業の流れは以下のとおりです。
(注)1 製品販売/代金回収を示しております。
2 契約一時金は提携契約締結時に収益となるものであり、マイルストーンペイメントは開発過程において提携契約に定める一定の段階を達成した場合に収益となるものです。
3 業務委託先とは受託臨床試験機関(以下「CRO」という。)や薬事アドバイザー等です。
4 連結子会社である3-D Matrix,Inc.であります。
D MITとのライセンス契約について
当社が開発・販売している製品の基盤となる自己組織化ペプチド技術はMITの研究者の発明によるものであり、MITは、かかる技術に関連する技術を多数有しています。当社子会社は2003年4月にMITとの間でExclusive Patent License Agreementを締結し、MITから、全世界における医療・生命科学・美容の分野にかかる同特許の独占的実施権(再許諾権付)の許諾を受け、また、当社は2004年10月に当社子会社との間でLicense and Supply Agreementを締結し、当社子会社からアジア地域における同分野にかかる同特許の実施権の再許諾を受けています(なお、2007年10月の米国3-D Matrix,Inc.の当社子会社化に伴い、当社及び当社子会社は2009年4月に同契約について必要な改訂を行っております。)。なお、MITからライセンスを受けている特許以外にも、当社は、次世代の自己組織化ペプチドを独自に開発して、また、当社グループ独自にまた共同研究パートナーと共同で開発した自己組織化ペプチド技術を基盤とした応用技術に関し、当社グループ単独または共同研究パートナーと共同で特許出願を行い、その中のいくつかについて特許登録を受けております。
(3) 製造
吸収性局所止血材の製造に関して、扶桑薬品工業株式会社との間での従前の製造受委託契約は一旦解消されましたが、改めて製造受委託契約を締結して継続して製造を委託しており、さらにドイツのPharmpure社との間で製造委受託契約を締結し、同社における製造も開始しております。
(4) 販売
販売が先行している欧州地域においては、消化器内視鏡手技向けに、2019年6月にFUJIFILM Europe B.V.(以下「FUJIFILM」という)とTDM-621の独占販売契約を締結し、同社において販売を開始しております。また、心臓外科手術領域及び耳鼻咽喉領域については主に直販体制による販売を行っております。
オーストラリアに関しては、当初現地代理店による販売を行いましたが、販売力強化のため、2019年4月期より、直販体制に移行しております。
日本においては、扶桑薬品工業株式会社との間で締結されていた独占販売権許諾契約の終了後、当社による直販による新たな販売体制を構築し、営業職員を採用するとともに内視鏡関連の販売に非常に強い代理店を23社、地域毎に選定し、代理店契約を締結し、各代理店との緊密な協業活動を行っております。
米国においては、耳鼻咽喉科領域を皮切りに消化器内視鏡領域等での販売拡大に向けて直販のための販売体制を強化しており、2023年4月期より相当の規模での販売拡大を目指しております。
その他の地域においては、アジア地域を中心に、韓国をはじめとする多くの地域において現地パートナーとの独占販売契約を締結し、地域内での独占販売権を許諾しております。また、2013年3月には、医療機器の品質マネジメントシステムのための国際標準規格ISO13485の認証を取得しており、各国への輸出を実施しております。
(用語解説)
用語 | 意味・内容 |
自己組織化ペプチド | 生理的条件下(中性pH、塩の存在)に置くと、ペプチド分子同士が規則的に集合し、ナノファイバーを形成するペプチド群。 |
アミノ酸 | 同一分子内にカルボキシル基(-COOH)とアミノ基(NH2)を有する化合物。 |
アルギニン(R) | タンパク質を構成する塩基性アミノ酸の一種。ヒトの非必須アミノ酸であり、天然に存在し食物では肉類・大豆・牛乳に多く含まれる。 |
アラニン(A) | タンパク質を構成する中性アミノ酸の一種。ヒトの非必須アミノ酸であり、天然に存在し食物では肉類・大豆・牛乳に多く含まれる。 |
アスパラギン酸(D) | タンパク質を構成する酸性アミノ酸の一種。ヒトの非必須アミノ酸であり、天然に存在し食物では肉類・大豆・牛乳に多く含まれる。 |
ペプチド | アミノ酸が2個以上結合した化学物質(結合するアミノ酸の数によってジペプチド、ポリペプチドなどとも呼ばれる)。 |
pH | 酸性、アルカリ性を表す指標(水素イオン濃度)。 |
ゲル化 | 液体的な柔軟性を持ちつつ、個体のような弾力性を有する吸収性高分子素材であるゲルを生成すること。 |
細胞外マトリックス | 細胞の外側にあるコラーゲンなどの構造タンパク質、細胞の生着・増殖等を支える足場(Scaffold)材。 |
ADME試験 | ADMEとはAbsorption(吸収)・Distribution(分布)・Metabolism(代謝)・Excretion(排泄)の頭文字をとった名称で、医薬品等が体内に服用されてから体外に排泄されるまでの経過のこと。ADME試験とは、体内にある薬又は同等物の体内での存在期間、排出過程を時間単位で追跡していく薬物の動態試験。 |
タンパク質分解酵素 | タンパク質又はペプチドのペプチド結合を加水分解して、複数個のアミノ酸又はペプチドを生成する酵素であり、プロテアーゼ・ぺプチダーゼともいう。 |
DDS | 必要な薬物を必要な部位で必要な長さの時間、作用させるための薬物送達システム(工夫や技術)。Drug Delivery Systemの略称。 |
担体 | 吸着や触媒活性を示す物質を固定する土台となる物質。 |
MTA契約 | 研究試料供給契約をいう。研究試料(試薬、遺伝子や細胞、実験動物等)の提供を行うための契約で、その試料の取扱や権利、免責等について規定する。 |
プレフィルドシリンジ | 治療等に必要である医薬品が注射器(シリンジ)にあらかじめ充填され、すぐに使用できる状態のもの。 |
ブリスター包装 | 片面を比較的堅い材質の板状のものを使う薬の包装や厚紙を台紙とし商品名などを印刷し、商品を板状のプラスチックをバキュームフォームなどで成型し囲み込み台紙に接着した又はスライド式着脱可能な包装のこと。 |
止血剤製品群 | 外科手術等で生じた比較的狭い範囲での出血を止めるために使用されるもので、外科手術等において止血用途で使用される止血剤や組織接着剤等を含めた広義の製品群。 |
フィブリノゲン | 血液凝固因子の一つで、線維素性の血漿蛋白原。 |
用語 | 意味・内容 |
510(k) | 既存の医療機器と同等の機能を有する医療機器の登録制度。 |
粘膜下層剥離術 | 癌の周囲にヒアルロン酸などの薬液を注射し、十分な粘膜下膨隆を作ったうえで、さまざまな電気メスを用いて癌を少しずつ切りはがしていく早期胃癌や早期食道癌に対する比較的新しい手術方法。電気メスを用いて切り取るため、内視鏡的粘膜切除術とは異なり、切除する組織の大きさに制限がなく大きい病変を一括して切除することが可能。 |
内視鏡用粘膜下注入材 | 内視鏡的粘膜切除術や内視鏡的粘膜下層剥離術を実施する際に、病巣部を取りやすくするために、病巣部を隆起させるために使用する生理食塩液やヒアルロン酸などのもの。 |
血管内塞栓促進用補綴材 | 血管内に投与して塞栓を形成させ(血管を詰まらせ)、病巣部の血流を遮断することで病巣部の治療を意図する医療機器。 |
足場材 | 体内にあるコラーゲン等の細胞間マトリックスであり、細胞増殖のための足場となるもの。 |
自家骨 | 自分自身の骨。 |
他家骨 | 他人の骨。 |
GLP | 医薬品・医療機器の開発のために行われる前臨床試験(動物試験等、特に安全性試験)のデータの信頼性を確保するための実施基準。 |
bFGF | 塩基性線維芽細胞成長因子。創傷時における線維芽細胞増殖や血管新生に関与する。 |
PDGF | 血小板由来成長因子。主に間葉系細胞(線維芽細胞、平滑筋細胞、グリア細胞等)の遊走及び増殖などの調節に関与する。 |
界面活性 | 少量で液体の表面張力を低下させる物質。 |
A6K | 自己組織化ペプチドの一種で、アミノ酸配列AAAAAAKであるもの。水溶液中で粒子径が約50-100nmのナノチューブを形成する。 |
siRNA | 21-23塩基対から成る低分子二本鎖RNA。siRNAはRNA干渉(RNAi)と呼ばれる現象に関与しており、伝令RNA(mRNA)を分解することによって配列特異的に遺伝子の発現を抑制する。 |
償還価格 | 健康保険の給付対象となる医療機器等について、厚生労働省が定めた価格。 |
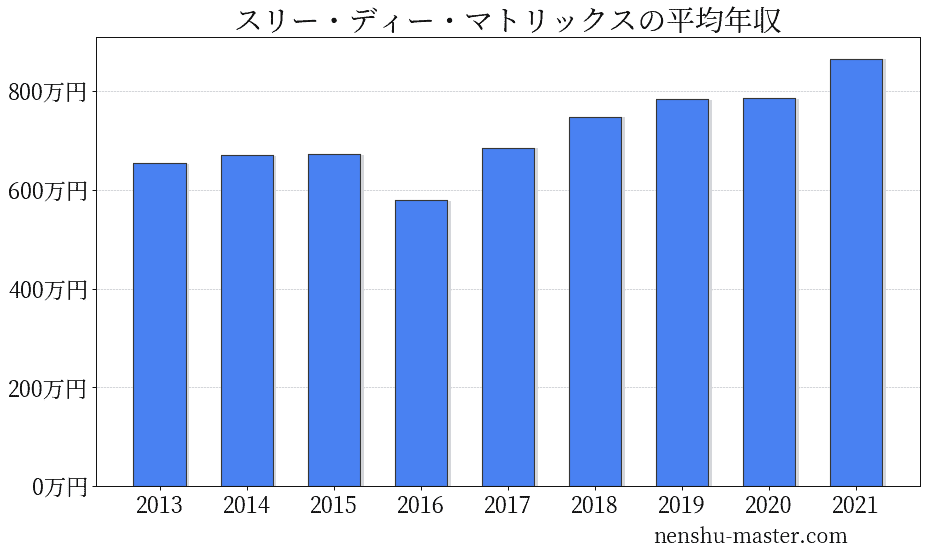
スリー・ディー・マトリックスの平均年収は866万円
生涯収入の全国平均である約1.9億円に対し、スリー・ディー・マトリックスの生涯収入はおよそ3.20億円と推定されます。
| 年 | 平均年収 |
|---|---|
| 2013 | 654万円 |
| 2014 | 670万円 |
| 2015 | 672万円 |
| 2016 | 579万円 |
| 2017 | 686万円 |
| 2018 | 748万円 |
| 2019 | 784万円 |
| 2020 | 786万円 |
| 2021 | 866万円 |
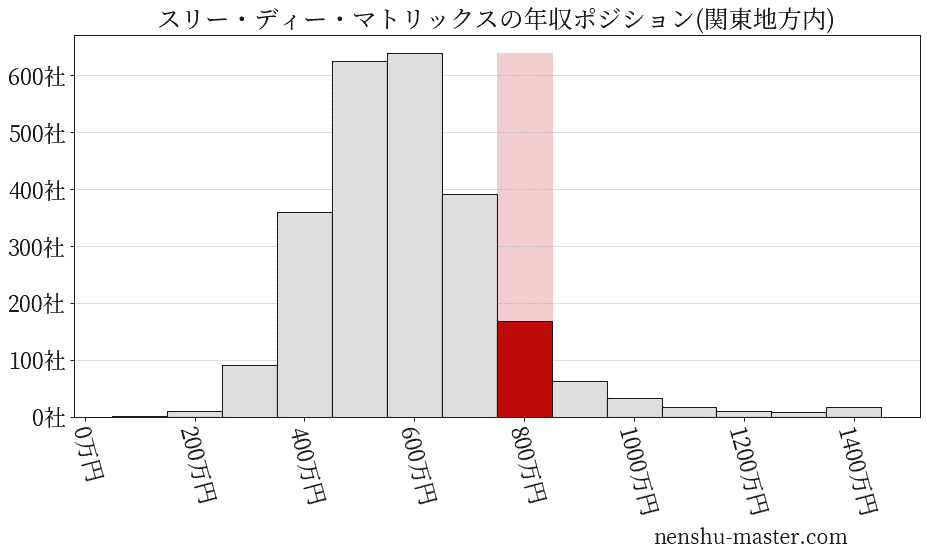
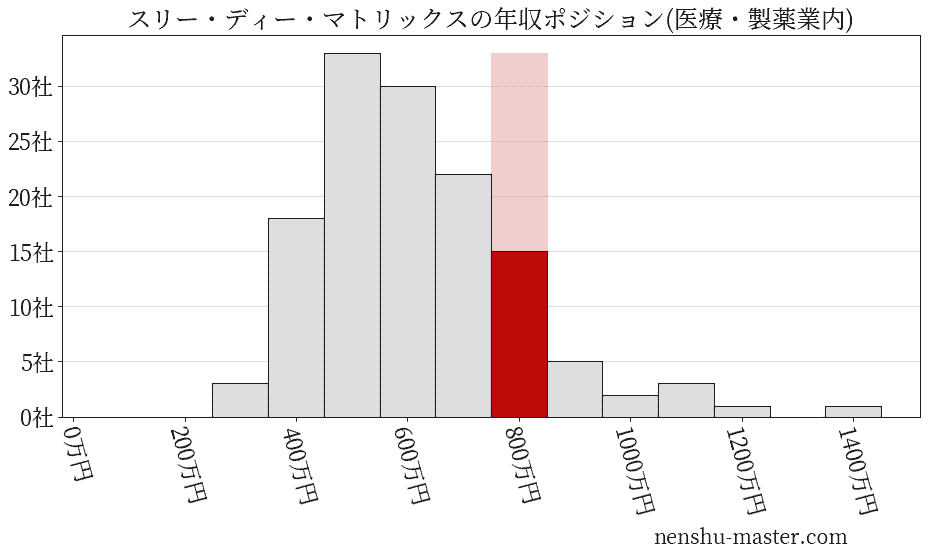
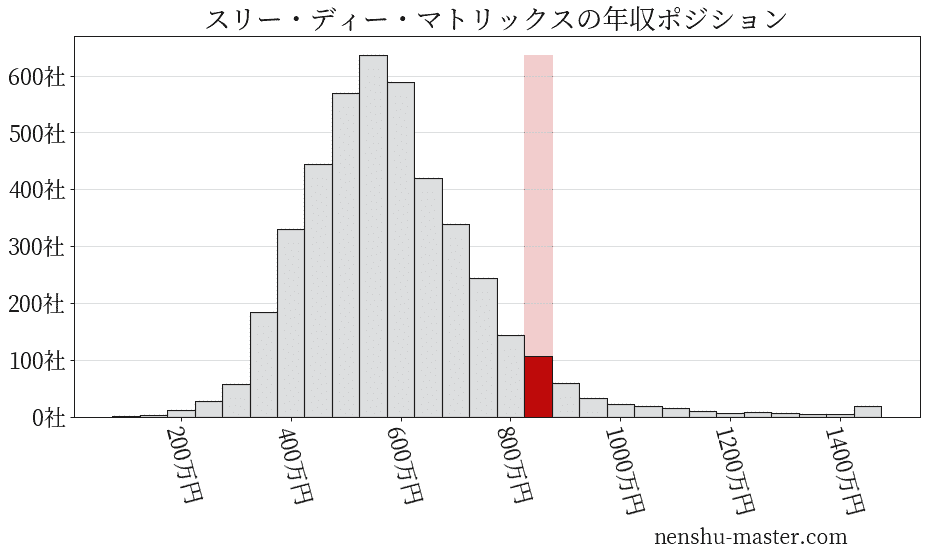
平均年収と社数のヒストグラム上ではスリー・ディー・マトリックスは赤色の箇所に位置しています。 年収ランキングではスリー・ディー・マトリックスは363位(全4687社)で、年収偏差値は70.6でした。
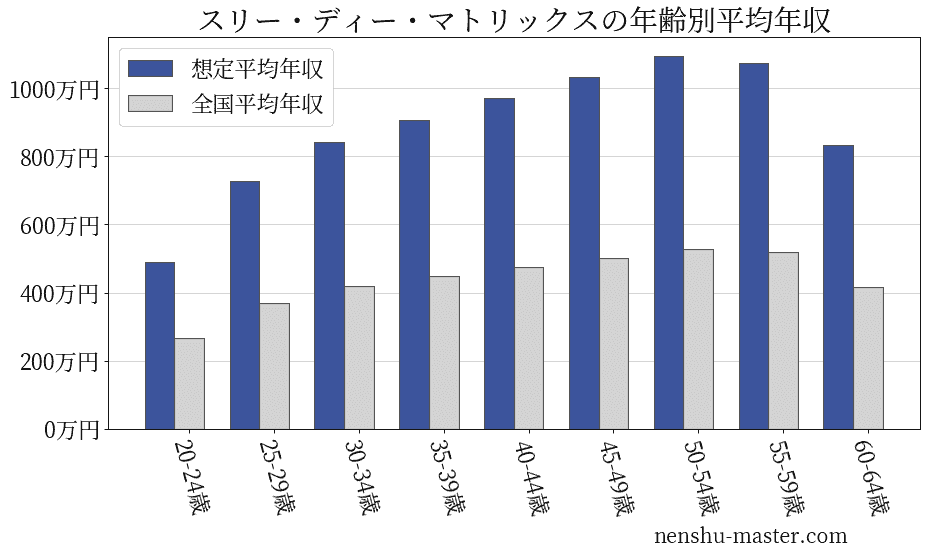
スリー・ディー・マトリックスの年齢別年収
| 年齢 | 想定平均年収 | 月額給与 |
|---|---|---|
| 20-24歳 | 489万円 | 38万円 |
| 25-29歳 | 727万円 | 56万円 |
| 30-34歳 | 843万円 | 65万円 |
| 35-39歳 | 908万円 | 70万円 |
| 40-44歳 | 973万円 | 75万円 |
| 45-49歳 | 1033万円 | 79万円 |
| 50-54歳 | 1095万円 | 84万円 |
| 55-59歳 | 1074万円 | 83万円 |
| 60-64歳 | 834万円 | 64万円 |
スリー・ディー・マトリックスの賞与・ボーナス
| 年 | 平均賞与額 |
|---|---|
| 2013 | 87万円 |
| 2014 | 89万円 |
| 2015 | 90万円 |
| 2016 | 77万円 |
| 2017 | 91万円 |
| 2018 | 100万円 |
| 2019 | 105万円 |
| 2020 | 105万円 |
| 2021 | 115万円 |
スリー・ディー・マトリックスの業種・地域
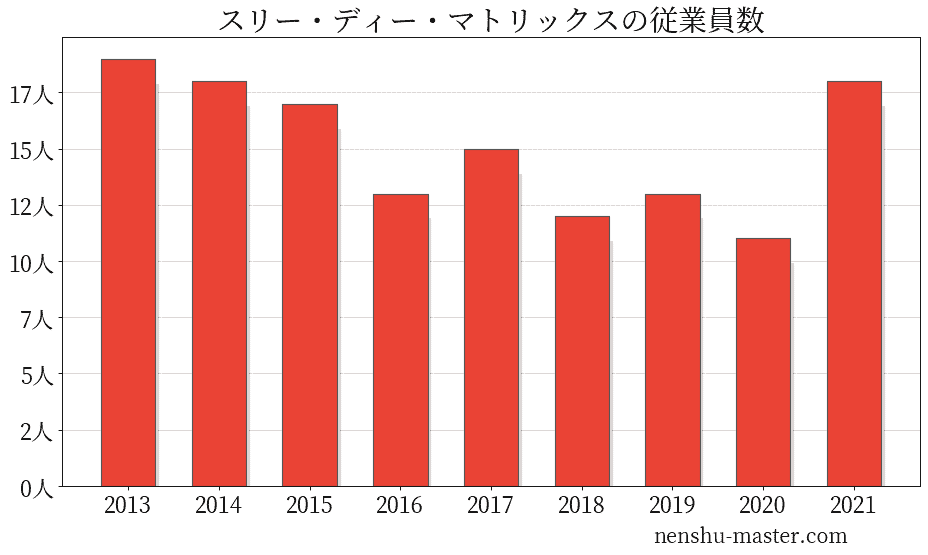
スリー・ディー・マトリックスの従業員数は18人
| 年 | 従業員数 |
|---|---|
| 2013 | 19人 |
| 2014 | 18人 |
| 2015 | 17人 |
| 2016 | 13人 |
| 2017 | 15人 |
| 2018 | 12人 |
| 2019 | 13人 |
| 2020 | 11人 |
| 2021 | 18人 |
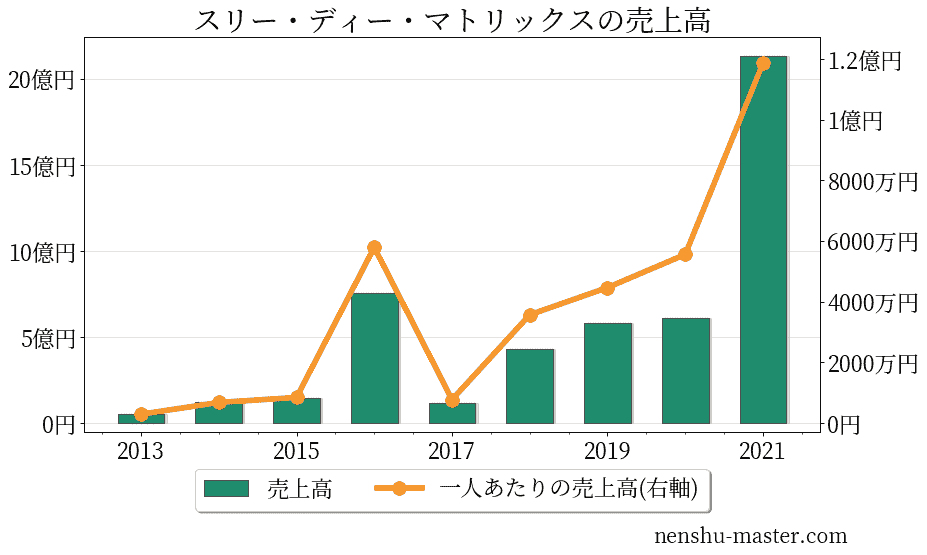
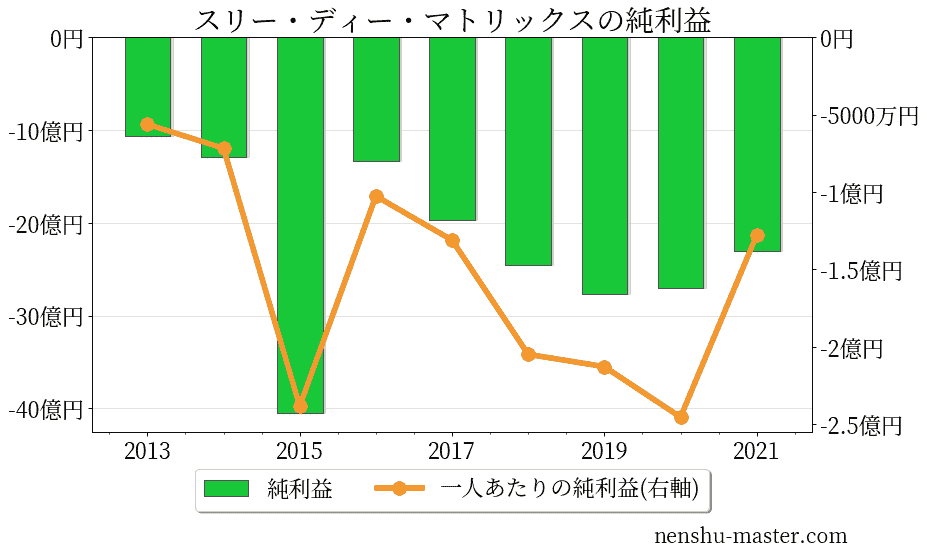
スリー・ディー・マトリックスの売上、純利益
【広告】スリー・ディー・マトリックスに転職するには?
転職サイトはサイトごとに特色があり、2〜3サイトを登録してそれぞれの良い部分を利用するのが賢い利用方法です。年収マスターイチオシのサイトを紹介します。
JACリクルートメント
「JACリクルートメント」はハイクラスな転職案件を多数持っており、市場価値の高い応募者におすすめのサイトです。 内資系の高額案件はもちろん、JACリクルートメントはイギリスやシンガポールでも展開しており、そのつながりを活かした外資系案件も多数あります。
他の転職サイトでは一気に大量の案件を提示されることがありどれを選べばわからないということが起こりますが、JACリクルートメントではそのようなことはありません。 ひとりの応募者につき複数のエージェントが担当し、選りすぐりの案件を紹介してくれるためマッチ度が高い仕事に出会えます。
ハイクラス案件をメインで扱うJACリクルートメントのみでしか得られない案件情報も多数あります。 上昇志向があり、現在のポジションからステップアップしてよりハイキャリアを目指す方にはイチオシのサイトです。
ランスタッド
「ランスタッド」は敏腕コンサルタントが専任で案件紹介をしてくれる転職サイトです。 ランスタッドのエージェントは評判が良く、最近人気が大きく伸びてきてきています。 よくある転職サイトはエージェントが十分なヒアリングも無くノルマ達成のためにたくさんの案件を紹介してきますが、 ランスタッドはそのようなことはありません。
ランスタッドは少数精鋭のコンサルタントで運営されており、現状のスキルや今後構築したいキャリアなどを入念にヒアリングした上で案件紹介をしてくれます。 特に20代後半から30代の転職に力を入れており、応募者にマッチした案件を紹介してくれます。
そのため案件の質も高く、JACリクルートメントと同様に高年収案件に強い印象です。800万円や1200万円を超える案件も多数あり、 ハイキャリアを目指す方には心強いパートナーです。ランスタッドのみでしか公開されてない案件もかなり多いので、 一度無料登録して相談してみることをオススメします。
参考書籍
スリー・ディー・マトリックスの歴史
| 2001年5月 | MIT発のバイオベンチャーとして米国において3-D Matrix,Inc.設立 |
| 2004年5月 | 自己組織化ペプチド技術の日本における事業化を目的として㈱スリー・ディー・マトリックス・ジャパンを設立 |
| 2011年10月 | 大阪証券取引所JASDAQに株式を上場 |
| 2012年4月 | フランスに、当社100%出資の子会社として3-D Matrix Europe SAS.を設立 |
スリー・ディー・マトリックスの子会社
| 名称 | 事業内容 |
|---|---|
| 3-D Matrix,Inc. | 医療製品 事業 |
| 3-D Matrix Europe SAS. | 医療製品 事業 |
| 3-D Matrix Asia Pte.Ltd. | 医療製品 事業 |
| 3-D Matrix Medical Technology Pty Ltd | 医療製品 事業 |
| 3-D Matrix EMEA B.V. | 医療製品 事業 |
| 3-D Matrix UK Limited | 医療製品 事業 |
| 3-D Matrix Da America Latina Representação Comercial Ltda. | 医療製品 事業 |
| 3-D Matrix (Beijing)Biotechnology Co., Ltd | 医療製品 事業 |
| 3-D Matrix MedicalTechnology Limited | 医療製品事業 |
スリー・ディー・マトリックスの類似企業
| 企業名 | 平均年収 | 従業員数 |
|---|---|---|
| アンジェス | 1121万円 | 39人 |
| ステムリム | 667万円 | 44人 |
| アイロムグループ | 442万円 | 68人 |
| シンバイオ製薬 | 1208万円 | 118人 |
| UMNファーマ | 511万円 | 35人 |
| ソレイジア・ファーマ | 1310万円 | 21人 |
| デ・ウエスタン・セラピテクス研究所 | 610万円 | 17人 |
| 新日本科学 | 556万円 | 819人 |
| ペプチドリーム | 966万円 | 155人 |
| ヘリオス | 799万円 | 70人 |
スリー・ディー・マトリックスと平均年収が近い企業
| 企業名 | 平均年収 |
|---|---|
| ステラファーマ | 693万円 |
| 協和キリン | 902万円 |
| ソレイジア・ファーマ | 1310万円 |
| JCRファーマ | 882万円 |
| キョーリン製薬HD | 887万円 |
| 栄研化学 | 769万円 |
| テーオーシー | 700万円 |
| オンコリスバイオファーマ | 791万円 |
| あすか製薬HD | 958万円 |
| 大塚HD | 1041万円 |