UMNファーマの平均年収
UMNファーマとは
| 企業名 | UMNファーマ |
|---|---|
| 本社所在地 | 秋田市御所野湯本四丁目2番3号 |
| 売上高 | 1.04億円 |
| 社員数 | 35人 |
| 平均年収 | 511万円 |
| 推定初任給 | 24万円 |
| 年収偏差値 | 51.9 |
| 平均年齢 | 37.2歳 |
| 平均勤続年数 | 2.3年 |
有価証券報告書によるとUMNファーマの事業内容は次の通りです。
(1)当社の事業概要
当社は、製薬業界で培った豊富な開発経験と幅広いネットワークを駆使し、満足な治療法や製造技術のない領域にて、革新的な医薬品を迅速に開発することを会社のミッションに掲げ、平成16年4月に設立されました。
当社は、これまで当社及び連結子会社(株式会社UNIGEN)によりグループ体制が構成されておりましたが、平成29年1月31日に、当社連結子会社である株式会社UNIGENの当社保有株式全株を譲渡したため、以降は当社単体にて事業を推進しております。従いまして、以下に関しまして、当社単体での事業の内容を記載しております。
当社は、独自の技術プラットフォームの整備を通じて、次世代バイオ医薬品自社開発事業に加え、開発初期から中期段階におけるバイオ医薬品等の受託製造事業も事業領域とするバイオファーマ企業であります。次世代バイオ医薬品自社開発事業においては、ヒト用感染症予防ワクチンをはじめとする次世代バイオ医薬品原薬製造技術、アジュバント技術及び製剤/ドラッグ・デリバリー技術等を統合して次世代ロジカルワクチン(詳細は後記「① 次世代ロジカルワクチンの創製」に記載)の研究開発を行っており、開発パイプラインごとに対象疾患領域及び臨床現場の状況、競合する医薬品の状況などを総合的に勘案し、医薬品としての価値を最大化できる最適のタイミングで国内外の製薬企業と提携しライセンスアウトし、契約一時金、開発マイルストーンフィー及び販売開始後のランニングロイヤリティより収益を確保していくビジネスモデルを基本としております。一方、バイオ医薬品等受託製造事業については、当社が保有する横浜研究所、秋田研究所及び秋田工場、これら研究開発・製造施設に従事する製造ノウハウに長けた豊富な人材を活用し、開発初期から開発中期段階までのCMC16)開発・工業化検討を中心として顧客ニーズに対応しつつ、高付加価値サービスを提供していくビジネスモデルを基本として、顧客に対して検討用サンプル・治験薬・製品・各種評価試験結果等を供給いたします。
なお、当社は医療用医薬品の研究開発及びこれに関連する事業の単一セグメントであるため、セグメント別の記載を省略しております。
以下に当社の事業系統図を示します。
<当社の事業系統図>
当社のミッション及びターゲット事業領域は以下のとおりであります。
〈ミッション〉
未充足医療領域のニーズを満たすべく、革新的バイオ医薬品を迅速に開発すること、世界に存在する優れたシーズの研究開発から開発段階、更には製品供給への意向を積極的に支援・橋渡しを行うことで、より効率的に生産が可能な高付加価値バイオ医薬品を創出・供給し、広く社会に貢献する。
〈ターゲット事業領域〉
事業領域=「次世代バイオ医薬品自社開発事業」+「バイオ医薬品等受託製造事業」
当社がターゲットとする事業領域は、バイオ医薬品開発・製造に関連する領域であり、当初より掲げている「次世代バイオ医薬品自社開発事業」及び「バイオ医薬品等受託製造事業」の2事業を中心に展開しております。
「次世代バイオ医薬品自社開発事業」においては、医療現場におけるバイオ医薬品の存在価値はますます高まっており、当社として革新的なバイオ医薬品を創出することに今後も大きな事業機会が存在していると考えております。当社がこれまで開発してきたバイオ医薬品技術プラットフォームの各種知見・ノウハウ・技術を活用し、「次世代バイオ医薬品自社開発事業」として、主にヒト用感染症予防ワクチンの原薬となる組換えタンパク抗原の製造技術、アジュバント技術及び製剤/ドラッグ・デリバリー技術等を統合した次世代ロジカルワクチンの研究開発を通じて、既存自社開発パイプラインの構築を図るとともに、新規シーズの探索・導入を進め、製薬企業等との提携による収益獲得を目指しております。当該事業分野においては、提携後の自社開発資金負担の軽減・平準化を重視した、契約一時金・開発協力金・開発マイルストーンフィー・ランニングロイヤリティを中心とした収益構造を目指しております。
なお、当社は、平成29年10月31日に、塩野義製薬株式会社とヒト用感染症予防ワクチンをはじめとする創薬に関する基盤技術整備ならびに当社既存自社開発パイプラインの一部及び新規開発候補ターゲットで構成される開発候補品の基礎的研究を共同で行うことを目的とした資本業務提携契約を締結、上記事業の構築に向けた研究開発活動を推進しております。
一方、「バイオ医薬品等受託製造事業」においては、平成29年1月31日付にて、当社連結子会社であった大規模生産施設を有する株式会社UNIGENの当社保有株式全株を譲渡したことにより、大規模商用生産を前提とするバイオ医薬品の製造及び供給事業からの転換を図っております。当社におけるリソースは、これまで組換えインフルエンザHAワクチン等の開発で培った知見・ノウハウ及び当社が保有する横浜研究所、秋田研究所及び秋田工場であり、これらを活用して、バイオ医薬品開発プロセスのうち、「研究段階から開発段階、更には製品供給への移行の支援・橋渡し」、具体的には「バイオ医薬品のCMC開発・工業化検討」に特化し、事業会社や国内外研究機関より、初期開発段階にあるバイオ医薬品等原薬の受託製造、原薬製造工程プロセス開発受託、工程規格試験等の各種品質管理に関する分析試験の規格化の業務受託、スケールアップを目的とする工業化検討業務受託等を事業として展開することにより、安定的な収益確保を目指しております。
なお、上述の塩野義製薬株式会社との資本業務提携契約締結に伴い、当該資本業務提携に係る業務に経営資源を集中することとし、当該提携に支障のない範囲で次世代バイオ医薬品自社開発事業に資すると考えられる大学等の研究機関からの将来の新規開発候補ターゲットに関連する受託業務を中心に受注活動を展開しております。
(当社事業の特徴)
① 次世代ロジカルワクチンの創製
当社が目指す次世代ロジカルワクチンとは、当社がこれまで開発してきたバイオ医薬品技術プラットフォームの各種知見・ノウハウ・技術を活用して、ヒト用感染症予防ワクチンをはじめとする次世代バイオ医薬品の原薬となる組換えタンパク抗原の製造技術、アジュバント技術及び製剤/ドラッグ・デリバリー技術等を統合したワクチンであります。次世代ロジカルワクチンは、対象となる感染症に最適な高い有効性及び高生産性の実現を目指しております。
次世代ロジカルワクチンでは、製剤/ドラッグ・デリバリー技術等を活用して、対象となる感染症毎に最適な免疫を誘導することにより、高い有効性を実現することが可能となります。また、アジュバント技術を活用して、より少ない抗原量で高い有効性を実現するのみならず、組換えタンパク抗原を効率よく生産する技術により、当社の現製造体制にて市場をカバー可能な供給量を確保することが可能になるとともに、コスト低減に寄与することが可能となります。
当社は、平成29年10月31日に締結した塩野義製薬株式会社との資本業務提携を通じて、次世代ロジカルワクチンの研究開発を推進することを目的とした、ヒト用感染症予防ワクチンをはじめとする創薬に関する基盤技術整備ならびに当該基盤技術を活用した当社既存自社開発パイプラインの一部及び新規開発候補ターゲットで構成される開発候補品の基礎的研究を推進しております。
② ヒト用感染症予防ワクチンを中心とする複数の開発パイプラインの開発
当社は、ノロウイルス、ロタウイルス、インフルエンザウイルスに対するヒト用感染症予防ワクチンなど、ウイルス感染症領域における複数の開発パイプラインを有しております。平成29年10月31日に締結した塩野義製薬株式会社との資本業務提携を通じて、①に記載の当該基盤技術を活用した当社既存自社開発パイプラインの一部及び新規開発候補ターゲットで構成される開発候補品の基礎的研究を推進しております。
③ 小~中規模バイオ医薬品製造施設を保有
当社は、ラボスケールから中規模(パイロットスケール)の工場を保有していることに加え、組換えインフルエンザHAワクチン等の開発経験を通じて、バイオ医薬品をラボスケールから大規模商用生産スケールまで、一貫した品質を維持しつつスケールアップに成功した経験を有しております。バイオ医薬品のCMC開発・工業化検討においては、初期研究段階からパイロットスケールへのスケールアップにおいて、商用生産を想定した適切な検討がなされることが、製品製造までの成功において最も重要と考えられますが、当社では、これまでの組換えインフルエンザHAワクチン等の開発・審査対応経験より一定のノウハウが蓄積されております。
当社は、以上のバイオ医薬品製造施設及び開発ノウハウを用いて、ヒト用感染症予防ワクチンを中心とする自社開発パイプラインによる次世代ロジカルワクチンの創製を推進しております。平成29年10月31日に締結した塩野義製薬株式会社との資本業務提携においては、当社が保有する製造施設を生かした製造機能を担う役割を果たします。
<ターゲット事業領域と開発プロセス領域>
<当社の研究開発・製造拠点>
(2)医薬品の研究開発プロセスと当社事業が関連するプロセス領域について
医療用医薬品を製造、販売するためには厳格な規制が存在し、これら規制を遵守しながら開発を進めていかなければなりません。医療用医薬品が販売されるまでに実施される一般的な研究開発の目的及び内容ならびに各段階における関連規制について説明いたします。
<医薬品の開発プロセス>
大別すると、① 基礎研究、② GLPに基づく非臨床試験、③ 製剤開発及び工業生産方法の確立(GMP)、④ GCPに基づく臨床試験、⑤ 製造販売承認に関する申請、⑥ GQP、GVP及びGPSPの6つのステップに区分されます。さらに、バイオ医薬品製造のプロセスのひとつに遺伝子組換え技術が存在するため、⑦ 遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(カルタヘナ法)の遵守、を加え、以下に各ステップについて詳細を記載いたします。
① 基礎研究
ターゲットとする疾患を決定し、将来医薬品となる可能性のある物質を特定して、試験管内もしくは動物(以下、「in vivo」といいます。)による疾患モデルを確立し、スクリーニングにかけて、リード化合物17)の選定を行います。当該リード化合物の物理的・化学的特性を確認した後、化学修飾18)を行い、in vivo実験により、高い安全性と有効性を有する開発候補化合物を選定いたします。その後、信頼性基準19)に基づき、大型哺乳動物などでより精緻に薬効・安全性の確認を行うとともに、投与方法や製造方法の検討を行うために、物性試験20)、薬物動態試験21)等を実施いたします。
② GLPに基づく非臨床試験
GLP(Good Laboratory Practice)とは、臨床試験を始めるに当たって特にヒトでの安全性を推測できるデータを取得するものであり、単回毒性試験22)、反復毒性試験23)、がん原性試験24)、変異原性試験25)などを実施し、化合物の安全性に関するデータを収集いたします。一定の安全性の検証を行うための基準として、「医薬品の安全性に関する非臨床試験の実施の基準に関する省令」(平成9年3月26日厚生省令第21号 最終改正平成26年7月30日号外厚生労働省令第87号)に、試験方法、実施者、設備等が厳格に定められております。一連の非臨床試験データを揃え、臨床試験の目的及び具体的内容について治験届を当局に提出し、その内容について当局より確認を得た後に、臨床試験を開始することになります。
③ 製剤開発及び工業生産方法の確立
製剤開発は非臨床試験の前後より開始いたします。製剤の処方設計を行い、臨床試験に使用する治験薬を製造いたします。治験薬の製造には、治験薬GMP(Good Manufacturing Practice 「治験薬の製造管理及び品質管理基準」及び「治験薬の製造施設の構造設備基準」(治験薬GMP)26)(平成9年3月31日薬発第480号 最終改正平成20年7月9日薬食発第0709002号))に従わなければなりません。さらに、上市後の製品の製造に向けて工業生産方法の確立が必要になります。そのためには、GMP「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」(平成16年12月24日厚生労働省令第179号 最終改正平成26年7月30日号外厚生労働省令第87号)に定められた基準に従って製造を行う必要があり、当該GMPに準拠して製造がなされているかどうかについて当局からの査察等が実施されます。なお、GMP基準は医薬品製造業の許可要件ならびに医薬品製造販売の承認要件となっております。GMP適合施設を保有するために、これら厳密な規制を完全にクリアする必要があります。
④ GCP基準に基づく臨床試験
臨床試験については、GCP(Good Clinical Practice 「医薬品の臨床試験の実施の基準に関する省令」(平成9年3月27日厚生省令第28号 最終改正平成29年10月26日号外厚生労働省令第116号))が定められており、医薬品の製造承認の申請に際し必要な臨床試験成績に関する各種資料の取得、管理、治験実施者の選定・依頼及び実施等について厳格な基準が定められております。
第Ⅰ相臨床試験は、少数の健康人に与薬し、薬物動態や安全性の確認を行います。第Ⅱ相臨床試験の前期では、少数患者に与薬し、安全性と有効性について確認を行います。この段階で、具体的な適応疾患及び投与用量のおおよその範囲について決定いたします。いわゆるPOC(Proof of Concept ヒトでの有効性の実証)は、前期第Ⅱ相臨床試験にて相応の薬効が示唆された段階をいいます。それに続く後期第Ⅱ相臨床試験では、対象数を増やして投与用量と効果の相関性を確認し、至適条件を決定いたします。第Ⅲ相臨床試験では、一般臨床上、安全性と有効性が確認されるのに十分な数の患者に対して、類似薬もしくは偽薬(プラセボ)27)との二重盲検比較試験28)を実施し、その医薬品が治療に貢献するものであるか否かの最終的な確認を行います。
なお、医薬品の開発については、平成3年に日米欧の薬事規制当局及び製薬団体によって設立されたICH(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use 「医薬品規制ハーモナイゼーション国際会議」)によって、世界レベルで臨床試験データの融和が図られております。主に国や地域間で承認申請データを相互活用し新規医薬品開発を効率化しようとするものであり、平成10年、海外臨床試験データ受け入れに関するガイドラインが最終合意されたことにより、一定の確認試験を実施すること等を条件に、異なる地域での臨床試験データを共有した承認申請が可能となっております。
⑤ 製造販売承認に関する申請
品質試験、非臨床試験及び臨床試験の資料をまとめて製造販売の承認申請を行います。医薬品の成分・分量、用法・用量、効能・効果、副作用等に関する審査を行ったうえで、厚生労働大臣が品目ごとに承認を与えます。また、業として医薬品を製造する者は、医薬品製造業の許可を受けなければなりません。
⑥ GQP、GVP及びGPSP
医薬品の製造販売を行う場合、品質管理に関する基準としてGQP(Good Quality Practice 「医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準に関する省令」(平成16年9月22日厚生労働省令第136号 最終改正平成26年7月30日号外厚生労働省令第87号))を遵守する必要があります。
一方、GVP(Good Vigilance Practice「医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令」(平成16年9月22日厚生労働省令第135号 最終改正平成29年11月24日厚生労働省令第124号))として、医療機関等からの自発報告や文献・学会報告等から副作用や感染症に関する情報等の安全性情報を収集し、評価・検討の上、安全確保措置を講じる必要があります。GQP及びGVPは医薬品製造販売業の許可要件となっております。
製造販売後、医薬品の有効性と安全性を再審査及び再評価するために必要な情報等の収集・分析・報告に関する管理及び実施体制が、GPSP(Good Post-marketing Study Practice 「医薬品の製造販売後の調査及び試験の実施の基準に関する省令」(平成16年12月20日厚生労働省令第171号 最終改正平成29年10月26日号外厚生労働省令第116号)に定められております。
これらGQP、GVP及びGPSPは、医薬品製造販売業許可を取得する者がその責任を負うことになります。
⑦ 遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(カルタヘナ法)の遵守
国際的に、生物多様性条約が平成4年に採択され、翌年より発効いたしました。これを受けて、平成12年には生物の多様性を守るため、遺伝子組換え生物等の安全な取り扱い等につき、バイオセーフティに関するカルタヘナ議定書が採択され、平成15年より発効しております。本議定書は平成27年5月現在、170か国、欧州連合(EU)及びパレスチナが批准・締結をしております。通称「カルタヘナ法」は、「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」として、国際協調に基づき各国で立法化されており、日本では平成15年に法律が成立・公布され、平成16年より施行されております。これにより、遺伝子組換え生物の封じ込めが厳格に規定されており、違反した場合、罰則が存在いたします。遺伝子組換え生物を取り扱う研究室や工場の運営に当たっては、本法律の遵守が必須であります。なお、本議定書に関連して、平成22年10月に「バイオセーフティに関するカルタヘナ議定書の責任及び救済に関する名古屋・クアラルンプール補足議定書」が採択されており、平成29年12月時点において40か国及び欧州連合(EU)が締結したことから、平成30年3月に発効されております。
上記の医薬品の開発プロセスにおいて、当社が関連する領域は、医療用医薬品事業においては、① 基礎研究から⑦ カルタヘナ法の遵守までの領域のうち、⑥ 品質管理、安全管理及び製造販売後調査以外の全てとなります。当社は、ヒトの生命に関連する医薬品を開発する企業として、これらの法令・規制を徹底的に遵守する体制を整備し、事業を進めております。
<当社が主に関連するプロセス領域と遵守すべき法令・規制等>
(注) 網掛け領域が、現時点における当社事業に関連する開発プロセス領域となります。
(3)当社の研究開発体制について
① 当社の重点領域と人材について
当社は、取締役会及び研究開発・生産の各組織において、製薬企業で長年研究開発や申請業務を経験した人材を中心に構成されております。次世代バイオ医薬品自社開発事業につきましては、各種ワクチンの開発及び承認申請経験を有する人材を非臨床開発部及び生産技術開発部に配置し、研究開発を進めております。また、これまで組換えインフルエンザHAワクチン等の国内開発で培った知見・ノウハウ・技術を基に、主にCMC開発及び工業化検討において業務実績のある研究開発人材を配置するとともに、医療用医薬品工場の生産ライン部門、品質管理部門ならびに品質保証部門にて実務経験のある人材を積極的に採用しており、当社事業を発展させていくための運営体制を構築しております。
② 当社の研究施設と小~中規模原薬製造施設について
現在、当社は2つの研究施設を有しております。秋田大学医学部内にある秋田研究所では、動物実験等の基礎的研究を行っております。横浜研究所では、カルタヘナ法に準拠した250Lスケールまでのパイロット培養が可能な培養槽をもつ製造実験設備を保有し、次世代ロジカルワクチンの創製を目指し、バイオ医薬品原薬の製造工程となる培養及び精製に関する初期検討を実施しております。また、品質管理・工程管理に関する評価試験法の研究も行っております。
また、秋田県秋田市御所野湯本の秋田新都市産業団地約13,000㎡の敷地内に延べ面積約3,000㎡、600L培養槽3基を設置する治験薬GMP準拠のパイロットスケール原薬製造施設となる秋田工場を有しております。秋田工場は、平成22年7月より平成23年3月までを助成期間とした厚生労働省「新型インフルエンザワクチン開発・生産体制整備臨時特例交付金」交付事業(第一次分)における実験用生産施設整備事業の助成金にて整備し、平成23年4月より稼働しております。なお、秋田工場は将来においてGMP準拠施設に転用可能な設備設計となっており、当社が目指す次世代ロジカルワクチンの原薬製造拠点として整備拡充を図っております。また、秋田工場を運営するにあたり、人材面において徹底したGMP教育や管理教育を継続的に実施し、製造ライン要員の育成に努めております。
<当社の研究開発・製造拠点(再掲)>
(4)当社の自社開発パイプライン
当社は、以下の自社開発パイプラインの開発を遂行しております。なお、いずれの自社開発パイプラインも基礎的研究段階であります。
① 開発コード:UMN-104(組換えノロウイルスワクチン 旧開発コード:UMN-2002(組換えノロウイルスVLP単独ワクチン))
これまで開発コードUMN-2002として開発していた組換えノロウイルスVLP単独ワクチンは、フィンランドのタンペレ大学ワクチン研究センターのティモ・ヴェシカリ教授及びヴェスナ・ブラゼヴィッチ博士より、全世界における非独占の事業化権を取得し開発を進めている、ノロウイルスの2つの遺伝子型のウイルス様粒子(Virus Like Particle:VLP)をワクチン成分とする、多価ワクチンであります。
ノロウイルスは、ウイルス性胃腸炎の主要な原因ウイルスであり、毎年、全世界でノロウイルスにより約20万人が命を落としていると言われております(Emerg Infect Dis. 2008;Vaccine 2012)。先進国においては死に至るケースは少ないものの、医療経済的損失が甚大なためワクチンによる予防が求められておりますが、市販されたノロウイルスワクチンは未だないことから、本ワクチン接種により、ノロウイルスが原因となるウイルス性胃腸炎を予防することが期待されます。
ノロウイルスは、ウイルス遺伝子配列の相同性によって大きく2群(GⅠ、GⅡ)に分類され、GⅠはさらに15種類の遺伝子型GⅠ.1~GⅠ.15、GⅡはさらに20種類の遺伝子型GⅡ.1~GⅡ.20に分類されると言われております。UMN-2002は、複数の遺伝子型のノロウイルスに対して有効性を発揮するよう設計され、複数抗原のVLPを含みます。
なお、これまで、米国PSCより導入した技術を用いて開発を進めておりましたが、後述③に記載のとおり、PSCとのライセンス契約解消に伴い、当社として新たに開発コードUMN-104を付与し、上記の次世代ロジカルワクチンコンセプトに基づき、組換えノロウイルスワクチンとして、当社独自の技術にて研究開発を進めております。
② 開発コード:UMN-103(組換えロタウイルスワクチン 旧開発コード:UMN-2001(組換えロタウイルスVP6単独ワクチン))
これまで開発コードUMN-2001として開発していた組換えロタウイルスVP6単独ワクチンは、VP6の組換えタンパクをワクチン抗原とした単独ワクチンであります。ロタウイルスの粒子は、3層のカプシド(殻)タンパクで覆われており、中間のカプシドを構成するタンパクVP6によって群(A群~G群)が決定されます。ヒトのロタウイルス感染症の病原体としては、A群が最も一般的であることから、UMN-2001は、A群のロタウイルスから得られたVP6の組換えタンパクをワクチン抗原としております。
毎年、全世界でロタウイルスが原因で約45万人が命を落としていると言われております(Emerg Infect Dis. 2008;Vaccine 2012)。ロタウイルスに対する生ワクチンは多くの国で接種可能ですが、腸重積症を誘発する副反応の懸念が払拭できず、生ワクチンに代わる安全性の高いワクチンの開発が強く望まれると考えております。
なお、これまで、米国PSCより導入した技術を用いて開発を進めておりましたが、後述③に記載のとおり、PSCとのライセンス契約解消に伴い、当社として新たに開発コードUMN-103を付与し、上記の次世代ロジカルワクチンコンセプトに基づき、組換えロタウイルスワクチンとして、当社独自の技術にて研究開発を進めております。
③ 開発コード:UMN-101(組換え季節性インフルエンザワクチン 旧開発コード:UMN-0502(季節性組換えインフルエンザHAワクチン))
UMN-101は、一般的には季節性インフルエンザワクチンに当たるもので、毎年冬のシーズンに接種する予防ワクチンであります。
インフルエンザウイルスには、A・B・Cの3型があり、特にA型とB型は感染性が強く流行しやすいことからワクチンによる予防の対象となっております。これらのウイルス粒子表面にはHAとNA29)という2つの糖タンパクが存在しております。HAはインフルエンザウイルスが細胞に進入する際に機能するタンパクであり、NAは細胞内で増殖したウイルスが細胞外に出る際に機能するタンパクであります。これらが感染防御免疫の標的抗原とされております。A型に関しては、少なくとも16種類のHAが存在し、9種類あるNAとの組み合わせにより、ウイルスのタイプが決定されます。例えばH1N1インフルエンザウイルスは、HAの1番目の亜型とNAの1番目の亜型の組み合わせで構成されております。
<インフルエンザウイルスの構造>
これまで開発していた開発コードUMN-0502は、HAタンパクを抗原としてヒトに免疫応答を誘導する薬剤であり、H1N1の亜型、H3N2の亜型、B型等のウイルス株のHAが入った組換えインフルエンザHAワクチンであります。これまで、米国PSCより技術導入し、日本及び東アジアで開発を進めてまいりました。平成26年5月に当時の提携先であったアステラス製薬株式会社が、インフルエンザの予防の効能・効果で、厚生労働省に製造販売承認申請を行っておりましたが、審査当局より、リスク・ベネフィットの観点に鑑み、本剤の臨床的意義が極めて乏しく審査が継続できないとの判断が示されました。結果、平成29年1月に、アステラス製薬株式会社は、本剤の製造販売承認申請取り下げ、開発中止ならびに当社との細胞培養インフルエンザワクチン共同事業契約を解消いたしました。当該状況に鑑み、当社として米国PSCより導入した技術では日本での再開発及び再承認の可能性はないと判断するに至ったため、平成29年12月に米国PSCとのライセンス契約の解消に合意いたしました。これに伴い、当社として新たに開発コードUMN-101を付与し、上記の次世代ロジカルワクチンコンセプトに基づき、組換え季節性インフルエンザワクチンとして、当社独自の技術にて研究開発を進めております。
④ 開発コード:UMN-102(組換え新型インフルエンザワクチン 旧開発コード:UMN-0501(組換えインフルエンザHAワクチン(H5N1))、UMN-0901(組換えインフルエンザHAワクチン(H9N2等)))
UMN-102は、近年世界的流行の危険性が指摘され、世界レベルでその対応が急務となっている鳥インフルエンザウイルス(H5N1、H7N9、H9N2亜型等、高病原性ウイルスも含まれる)に対する予防ワクチン、すなわち新型インフルエンザワクチンであります。
インフルエンザウイルスの最も特徴的な性質は、毎年のように変異を起こすことであり、その程度により、ワクチンの効果は毎年のように変わります。また、変異の程度によって、しばしば世界的流行が起こります。この大流行は、一般的に「パンデミック」と呼ばれております。平成21年に新型インフルエンザA/H1N1のパンデミックが起きたことは、記憶に新しい経験であります。近年H5N1をはじめとする高病原性鳥インフルエンザウイルスが出現しており、渡り鳥の感染死や家鶏への伝播が数多く報告されております。種を超えて鳥からヒトへ、さらにヒトの間で感染するようになる、致死率の高いパンデミックを起こす危険性が指摘されております。交通機関の発達した現代においてパンデミックが起こると、感染は特定地域に留まらず、極めて短期間かつ広範囲に感染者数が増加する可能性があります。したがって、流行するインフルエンザウイルスの亜型に適合したワクチンを短期間で製造し、できる限り多くのヒトに対して接種することが感染拡大予防のために重要であります。UMN-102は、このようなパンデミック対応用の組換えインフルエンザワクチンであります。
これまでUMN-0501又はUMN-0901として開発を行ってまいりましたが、UMN-101と同様に、平成29年12月に米国PSCとのライセンス契約を解消することに合意したことに伴い、当社として新たに開発コードUMN-102を付与し、上記の次世代ロジカルワクチンコンセプトに基づき、組換え新型インフルエンザワクチンとして、独自に開発を進めております。
(5)塩野義製薬株式会社との資本業務提携について
当社は、平成29年10月31日に、塩野義製薬株式会社とヒト用感染症予防ワクチンをはじめとする創薬に関する基盤技術整備ならびに当社が次世代バイオ医薬品自社開発事業で開発を進めている自社開発パイプラインの一部及び自社開発パイプライン以外の新規開発候補ターゲットを当初の開発候補品として選定し基礎的研究を進めることを目的とした業務提携を行うとともに、塩野義製薬株式会社を割当先とする新株式及び第1回無担保転換社債型新株予約権付社債を発行いたしました。塩野義製薬株式会社との業務提携は、第1フェーズ及び第2フェーズの2段階で構成されており、当該資本業務提携は第1フェーズに関するものであります。第1フェーズの期間は、概ね平成31年12月末までを想定しております。
第1フェーズにおいては、当社と塩野義製薬株式会社は、当社の感染症予防ワクチンに関する各種知見・ノウハウ・技術を用いて、ヒト用感染症予防ワクチンをはじめとする創薬に関する基盤技術整備を行います。並行して、当社が次世代バイオ医薬品自社開発事業で開発を進めている自社開発パイプラインの一部及び自社開発パイプライン以外の新規開発候補ターゲットを当社の開発候補品として選定し基礎的研究を進めてまいります。第1フェーズ期間中においては、塩野義製薬株式会社から業務提携開始日より2年間にわたり、半年毎に当該期間に係るあらかじめ定めた成果の達成状況に基づき、一定額のマイルストーンフィーを収受することとなります。基盤技術整備に一定の成果が得られたと両社が判断した時点より、第2フェーズにステップアップするため、当社及び塩野義製薬株式会社は、並行して進めていた基礎的研究成果に基づき開発候補品の選択を行い、基盤技術整備により確立した技術を用いて、研究・開発・申請・上市を推進することを目的とした独占的ライセンス契約その他の形態による協業に関する契約について協議することとなります。第2フェーズに移行した場合、当社は、治験薬製造、商用生産準備及び商用生産ならびに開発対象として両社が決定した開発候補品の研究継続を行い、塩野義製薬株式会社が非臨床及び臨床試験の実施ならびに薬事対応及び販売を担うことを想定しております。
当事業年度末現在、提携第1フェーズにおいて、ヒト用感染症予防ワクチンをはじめとする創薬に関する基盤技術整備に係る第1回及び第2回開発マイルストーン条件の達成が確認されるに至っており、第3回以降の開発マイルストーン条件の達成に向けた研究開発活動を推進しております。並行して、当社が次世代バイオ医薬品自社開発事業で開発を進めている自社開発パイプラインの一部及び自社開発パイプライン以外の新規開発候補ターゲットを当初の開発候補品として選定し、基礎的研究に係る研究開発を推進しております。加えて、上記「(4)当社の自社開発パイプライン」に記載の当社自社開発パイプラインの一部及び新規開発候補ターゲットで構成される開発候補品の基礎的研究を推進しております。
(6)バイオ医薬品等受託製造(BCMO)事業について
当社は、次世代バイオ医薬品自社開発事業において整備した横浜研究所、秋田研究所及び秋田工場の施設群、これら施設に従事するバイオ医薬品生産・品質管理等のノウハウに長けた人材を活用して、バイオ医薬品等受託製造事業を展開しております。
平成24年7月に、アピ株式会社とバイオ医薬品受託製造事業に関する提携契約を締結し、原薬製造及び製剤化の一貫受注体制を確立するとともに、平成24年12月には、Catalent Pharma Solutions, Inc.と抗体医薬を対象としたバイオ後続品の生産株を非独占で供給を受ける契約を締結し、受注体制の整備を図ってまいりました。
これらの活動の結果、平成25年6月に、アピ株式会社及び株式会社ヤクルト本社とがん領域における抗体バイオ後続品に関する共同事業契約を締結、同年12月に2品目についても共同事業契約を締結いたしました。
以上は、当社連結子会社であった株式会社UNIGEN岐阜工場での受託製造を見据えた大規模生産を前提とした受託事業に向けた活動でありましたが、平成29年1月31日に、株式会社UNIGENの当社保有株式全株を譲渡したことに伴い、バイオ医薬品等受託製造事業において、ターゲットとする開発プロセス領域の絞り込みを行い、バイオ医薬品のCMC開発・工業化検討に特化した事業展開を図ることへと方針を転換いたしました。それに伴い、平成29年3月31日付にて、平成25年6月及び12月に締結したアピ株式会社及び株式会社ヤクルト本社との共同事業契約は解約することで合意いたしました。
受託領域絞り込み後における当該事業領域における当社の強みは、以下のとおりであります。
① これまでの自社開発パイプラインの研究開発を通じて培ったCMC開発・工業化検討に関する知見・ノウハウを活かした、研究段階から開発段階、更には製品供給への移行の支援・橋渡しにおける開発ソリューションを提供
② 開発初期から小~中規模生産まで顧客ニーズに応えることが可能な拠点・人員リソースを保有
なお、塩野義製薬株式会社との資本業務提携契約締結に伴い、当該資本業務提携に係る業務に経営資源を集中することとし、当該提携に支障のない範囲で次世代バイオ医薬品自社開発事業に資すると考えられる大学等の研究機関を中心として将来の新規開発候補ターゲットに関連する受託業務を中心に展開しております。
1)Protein Sciences Corporation
昭和58年に設立された米国コネチカット州メリデンにあるバイオベンチャー企業。タンパク製造技術BEVS(Baculovirus Expression Vector System (下記、2)を参照))に関する特許を有しており、医薬品用タンパク製造のための施設を有し、予防ワクチン、治験薬、診断薬の研究開発及びタンパク受託生産を主な事業としている。同社の季節性組換えインフルエンザHAワクチン「Flublok®」は平成25年1月FDAより18歳から49歳までを対象として承認を取得し、販売を開始している。平成29年8月にSanofi S.A.に買収され、完全子会社となる。
2)BEVS(Baculovirus Expression Vector System)
当社が米国PSCより技術導入していた、昆虫細胞及びベクターとなるバキュロウイルス(下記、30)を参照)を用いて組換えタンパクを生産する技術。
なお、当事業年度末現在は、米国PSCとのライセンス契約を解消しております。
3)組換え
ある種の成分を生産することを目的として、その成分の基となる遺伝子配列を違う種類の生物の遺伝子配列に組み込むことをいう。
4)HA(Hemagglutinin ヘムアグルチニン)
in vitroにて赤血球の凝集体を作らせる働きを有する糖タンパクで、インフルエンザをはじめとするウイルスや細菌等の表面に存在する。ウイルスは、ヘムアグルチニンの働きにより、細胞に感染する。HA1とHA2からなるモノマー(単量体)がトリマー(三量体)を形成する構造をとる。
5)多価
ワクチンの有効成分が、2つ以上含まれるものをいう。
6)H5N1
A型インフルエンザウイルス表面には、ヘムアグルチニン(HA)とノイラミニダーゼ(NA)があり、インフルエンザウイルスはHAとNAの種類によってHとNの番号が付される。A型インフルエンザウイルスにおいては、HAが少なくとも16種類(H1~H16)、NAは9種類(N1~N9)存在している。H5N1は、H5とN1の組み合わせをもつウイルス株であることをいう。
7)原薬
医薬品の成分のなかで、目的とする効果を示す化学成分のことで、医薬品の有効成分といわれるものをいう。
8)H9N2
6)に記載するH5N1と同様に、H9とN2の組み合わせをもつウイルス株であることをいう。H7N9も同様。
9)VLP(Virus Like Particle)
ウイルスの外殻のみを持ち、内部にはウイルスゲノムを持たない中空のウイルス様粒子のこと。ウイルスゲノムを持たないことから宿主内で増殖できないが、外殻に対する抗体産生を誘導する。VLPは、組換えタンパクの単一分子と比べはるかに大きく、樹状細胞やマクロファージなどの抗原提示細胞に病原体の如く貪食されやすいため、アジュバントなしで強力な免疫を誘導する抗原として期待されている。
10)ロタウイルスVP6
当社が開発中のロタウイルスに対するワクチンの成分。
「3 事業の内容 (4)当社の自社開発パイプライン ② 開発コード:UMN-103(組換えロタウイルスワクチン 旧開発コード:UMN-2001(組換えロタウイルスVP6単独ワクチン))」に詳細を記載しております。
11)アジュバント
ワクチンの免疫増強を目的とする医薬品添加物をいう。
12)希少疾病用医薬品(オーファンドラッグ)
医薬品医療機器等法第77条の2に基づき、対象患者数が本邦において5万人未満であること、医療上特にその必要性が高いものなどの条件に合致するものとして、薬事・食品衛生審議会の意見を聴いて厚生労働大臣が指定するものである。
13)ブースター
追加免疫効果のこと。体内で一度獲得された免疫機能が、再度抗原を接種することにより、さらに免疫機能が高まることをいう。
14)免疫原性
生体に投与した時、抗体の産生をもたらす性質のこと。通常、細菌やウイルスなどの外来病原体や人為的な注射などで体内に入るタンパクがこのような性質をもつ。
15)忍容性
医薬品を投与した場合、明白な有害作用(副作用)が被験者にとってどれだけ耐えうるかの程度を示す。忍容性が高いとは、全身性・局所性の副反応が少なく、与薬の継続に支障をきたさないことを意味する。
16)CMC
Chemistry, Manufacturing and control 医薬品における原薬プロセス研究、製剤開発研究及び品質評価研究を統合した概念
17)リード化合物
最終的な医薬品を導出する出発点となる化合物。生理活性を有し、その化学構造は医薬品としての有効性や薬物動態における要素を改良していくための始発点となる。開発を進めるために、化学構造を改良する必要がある。
18)化学修飾
ある物質に化学反応によって新しい原子団などを結合させること。低分子医薬品の場合、有効性の向上、安定性の向上、副作用の軽減等を目的として、様々な化学修飾の検討を経て候補化合物が決定される。
19)信頼性基準
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則第43条に定められる「申請資料の信頼性の基準」をいう。
20)物性試験
医薬品候補物質の構造、物理的・化学的性質、安定性、品質などを検証し、医薬品としての規格を決定することを目的とした試験をいう。
21)薬物動態試験
医薬品候補物質及びその代謝物の吸収・分布・代謝・排泄といった体内動態を検討し、安全域を推測するとともに、ヒトでの投与量や回数を推定することを目的とした試験をいう。
22)単回毒性試験
医薬品候補物質を単回投与し、その毒性を質的量的側面から明らかにすることをいう。
23)反復毒性試験
医薬品候補物質を複数回投与し、毒性変化を示す量、毒性の内容及び安全域を明らかにすることをいう。
24)がん原性試験
医薬品候補物質ががんを引き起こす要因になるかどうかを明らかにすることをいう。
25)変異原性試験
生物の遺伝情報(DNAあるいは染色体)に変化を引き起こす作用を有する物質又は物理的作用(放射線など)の性質あるいは作用の強さを明らかにすることをいう。
26)治験薬GMP
製造販売承認前に実施する治験において使用されるサンプルを製造する場合に適用されるGMP省令をいう。
27)偽薬(プラセボ)
真の医薬品と外見上は全く一緒であるが、医薬品としての有効成分が一切入っていない偽物の薬をいう。
28)二重盲検比較試験
被験者に割り付けられた治験薬(被験薬あるいは偽薬)を被験者だけでなく、医師を含む治験実施スタッフや治験依頼者も知らないように進める試験(Double Blind Study)。統計的にデータの信頼性を担保するための医薬品の臨床試験デザインの一つである。
29)ノイラミニダーゼ(Neuraminidase:NA)
動物の種々の臓器、微生物、ウイルスに存在する酵素で、シアル酸を糖タンパクや糖脂質から切り離す作用を有する。インフルエンザウイルスのもつノイラミニダーゼは、ウイルス表面にあるHAと宿主細胞表面のシアル酸の結合を切断することで、ウイルスが細胞外に放出され増殖することが可能となる。
30)バキュロウイルス(Baculovirus)
核多角体病ウイルス(NPV)と顆粒病ウイルス(GV)の2属に分けられるDNAウイルス。ビリオン(細胞外に存在し、感染性を有する完全なウイルス粒子)は大型の棒状をしている。種特異性が高く、節足動物(大部分はチョウ目の幼虫)に感染する。ヒトの細胞では感染増殖をしない。ヒトを含む哺乳動物に対しては病原性がなく安全である。
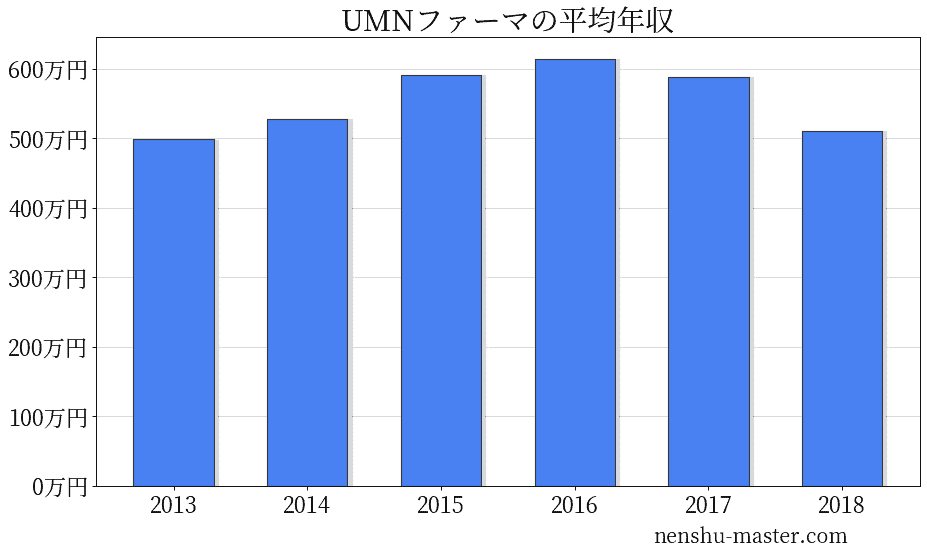
UMNファーマの平均年収は511万円
生涯収入の全国平均である約1.9億円に対し、UMNファーマの生涯収入はおよそ1.89億円と推定されます。
| 年 | 平均年収 |
|---|---|
| 2013 | 499万円 |
| 2014 | 528万円 |
| 2015 | 592万円 |
| 2016 | 615万円 |
| 2017 | 589万円 |
| 2018 | 511万円 |
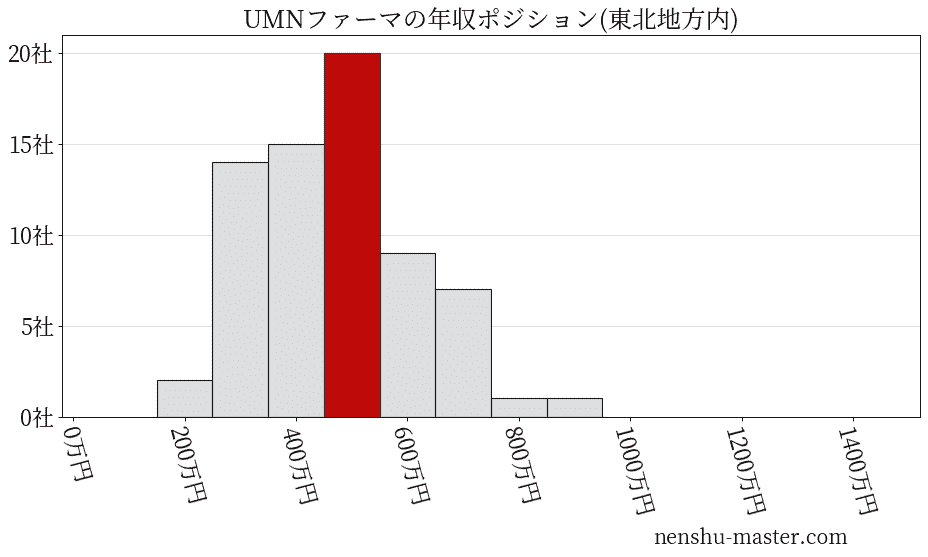
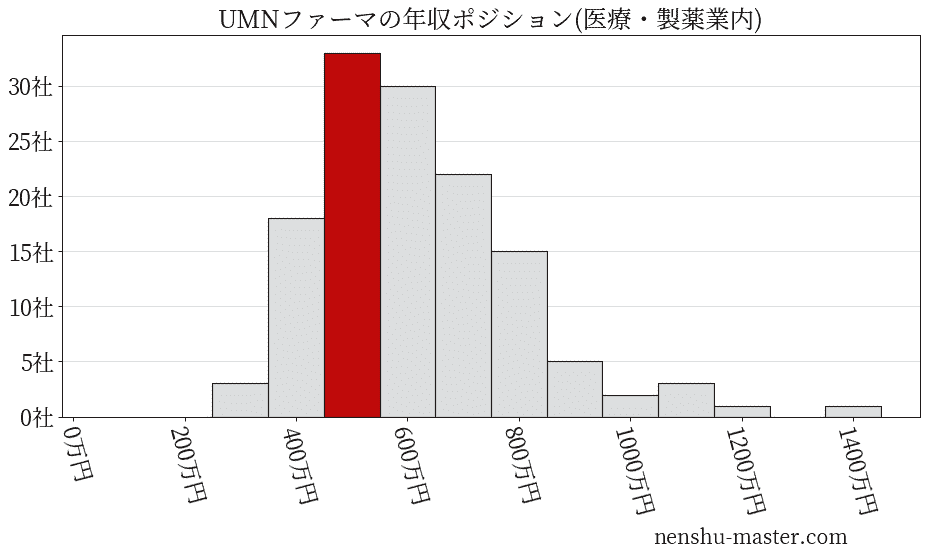
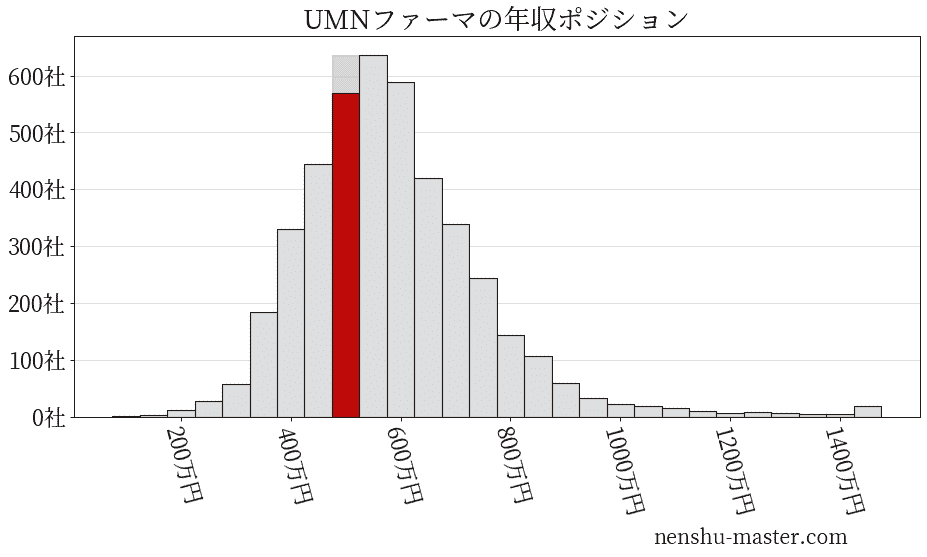
平均年収と社数のヒストグラム上ではUMNファーマは赤色の箇所に位置しています。 年収ランキングではUMNファーマは3486位(全4687社)で、年収偏差値は51.9でした。
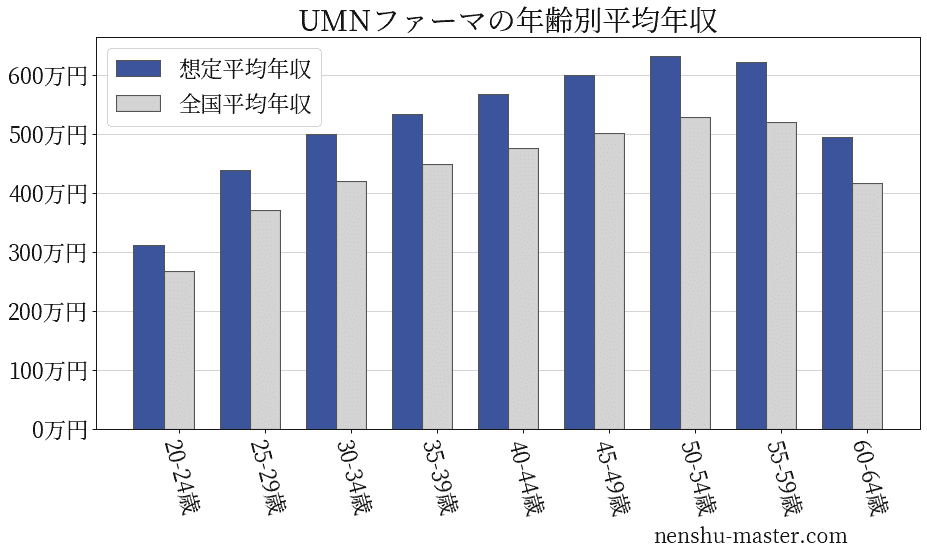
UMNファーマの年齢別年収
| 年齢 | 想定平均年収 | 月額給与 |
|---|---|---|
| 20-24歳 | 312万円 | 24万円 |
| 25-29歳 | 438万円 | 34万円 |
| 30-34歳 | 499万円 | 38万円 |
| 35-39歳 | 533万円 | 41万円 |
| 40-44歳 | 567万円 | 44万円 |
| 45-49歳 | 599万円 | 46万円 |
| 50-54歳 | 632万円 | 49万円 |
| 55-59歳 | 621万円 | 48万円 |
| 60-64歳 | 494万円 | 38万円 |
UMNファーマの賞与・ボーナス
| 年 | 平均賞与額 |
|---|---|
| 2013 | 67万円 |
| 2014 | 70万円 |
| 2015 | 79万円 |
| 2016 | 82万円 |
| 2017 | 79万円 |
| 2018 | 68万円 |
UMNファーマの業種・地域
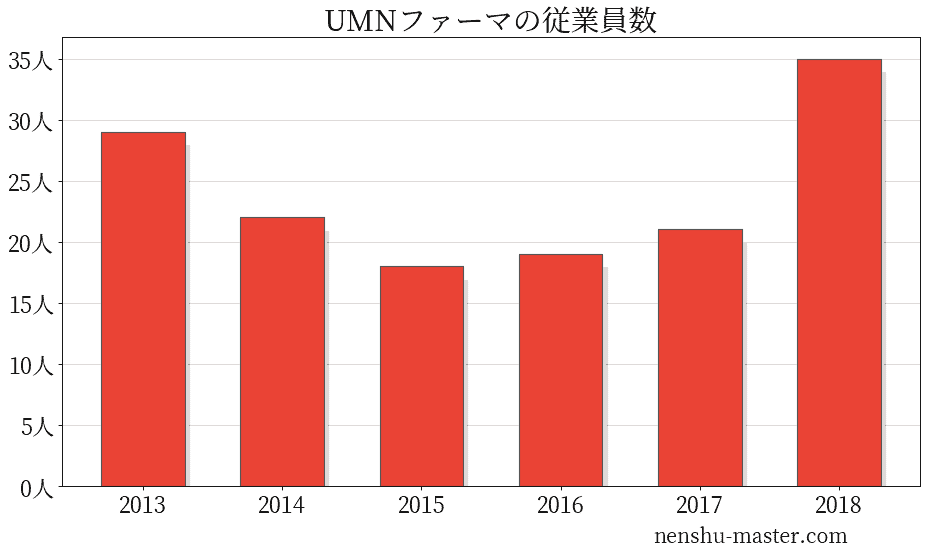
UMNファーマの従業員数は35人
| 年 | 従業員数 |
|---|---|
| 2013 | 29人 |
| 2014 | 22人 |
| 2015 | 18人 |
| 2016 | 19人 |
| 2017 | 21人 |
| 2018 | 35人 |
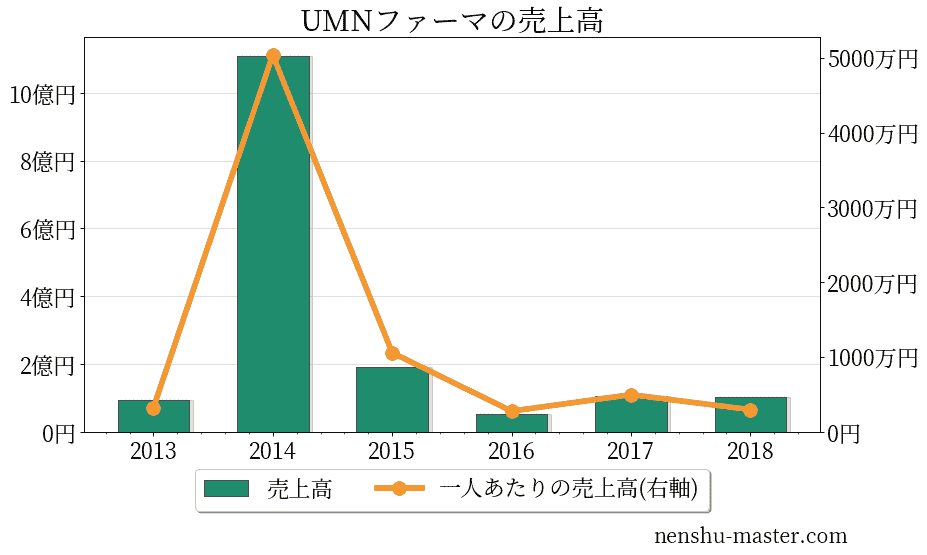
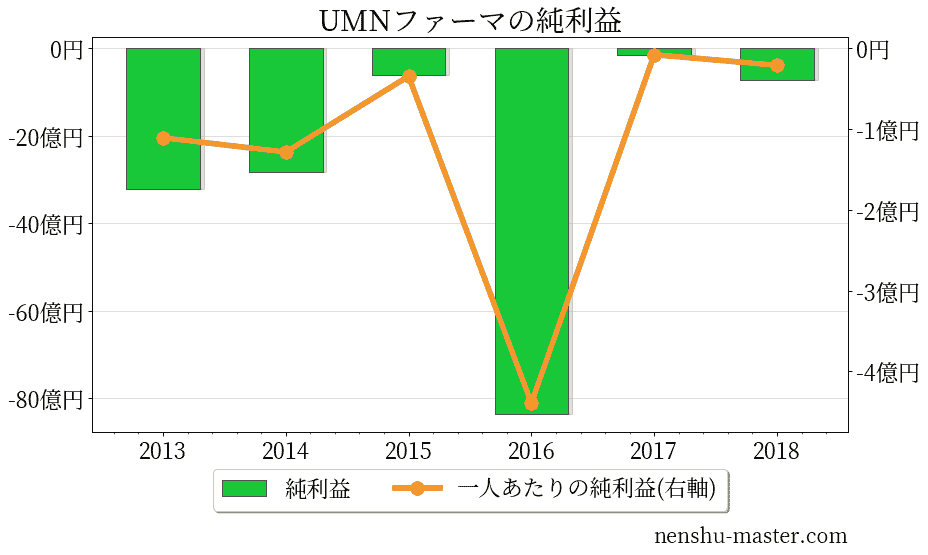
UMNファーマの売上、純利益
【広告】UMNファーマに転職するには?
転職サイトはサイトごとに特色があり、2〜3サイトを登録してそれぞれの良い部分を利用するのが賢い利用方法です。年収マスターイチオシのサイトを紹介します。
JACリクルートメント
「JACリクルートメント」はハイクラスな転職案件を多数持っており、市場価値の高い応募者におすすめのサイトです。 内資系の高額案件はもちろん、JACリクルートメントはイギリスやシンガポールでも展開しており、そのつながりを活かした外資系案件も多数あります。
他の転職サイトでは一気に大量の案件を提示されることがありどれを選べばわからないということが起こりますが、JACリクルートメントではそのようなことはありません。 ひとりの応募者につき複数のエージェントが担当し、選りすぐりの案件を紹介してくれるためマッチ度が高い仕事に出会えます。
ハイクラス案件をメインで扱うJACリクルートメントのみでしか得られない案件情報も多数あります。 上昇志向があり、現在のポジションからステップアップしてよりハイキャリアを目指す方にはイチオシのサイトです。
ランスタッド
「ランスタッド」は敏腕コンサルタントが専任で案件紹介をしてくれる転職サイトです。 ランスタッドのエージェントは評判が良く、最近人気が大きく伸びてきてきています。 よくある転職サイトはエージェントが十分なヒアリングも無くノルマ達成のためにたくさんの案件を紹介してきますが、 ランスタッドはそのようなことはありません。
ランスタッドは少数精鋭のコンサルタントで運営されており、現状のスキルや今後構築したいキャリアなどを入念にヒアリングした上で案件紹介をしてくれます。 特に20代後半から30代の転職に力を入れており、応募者にマッチした案件を紹介してくれます。
そのため案件の質も高く、JACリクルートメントと同様に高年収案件に強い印象です。800万円や1200万円を超える案件も多数あり、 ハイキャリアを目指す方には心強いパートナーです。ランスタッドのみでしか公開されてない案件もかなり多いので、 一度無料登録して相談してみることをオススメします。
参考書籍
UMNファーマの歴史
| 平成16年4月 | 未充足医療ニーズを満たす新規医療用医薬品の研究開発及び製造販売を目的として、秋田県秋田市に株式会社UMNファーマを設立 |
| 平成16年12月 | 東京支社を東京都港区に開設 |
| 平成18年10月 | 秋田大学医学部内に秋田研究所を開設 |
| 平成20年6月 | UMN-0501の第Ⅰ/Ⅱ相臨床試験を国内にて開始 UMN-0501が希少疾病用医薬品12)に指定 |
| 平成21年10月 | UMN-0501の第Ⅱ相臨床試験を国内にて開始 |
| 平成22年4月 | アピ株式会社とUMN-0502及びUMN-0501製剤工程の委託に関する基本協定書を締結 秋田県秋田市にて組換えインフルエンザHAワクチン原薬製造施設の建設を開始 |
| 平成22年5月 | 株式会社UNIGENを設立、当社連結子会社となる |
| 平成22年10月 | UMN-0501のブースター13)試験を開始 |
| 平成23年8月 | UMN-0501高用量試験を開始 UMN-0502第Ⅰ/Ⅱ相臨床試験を開始 |
| 平成24年3月 | BEVS技術を用いたバイオ医薬品原薬生産施設である岐阜工場の建設を開始 UMN-0501の高用量試験において免疫原性及び良好な忍容性を確認 |
| 平成24年12月 | 東京証券取引所マザーズ市場に株式を上場 Catalent Pharma Solutions,Inc.とバイオ後続品の生産細胞株を非独占で提供を受ける契約を締結 日東製薬株式会社とUMN-0502、UMN-0501及びUMN-0901の韓国での共同開発、独占的販売に関する契約を締結 |
UMNファーマの子会社
| 名称 | 事業内容 |
|---|---|
| 塩野義製薬株式会社 | 医療用医薬品の研究開発、仕入、製造、販売並びにこれらの付随業務 |
UMNファーマの類似企業
| 企業名 | 平均年収 | 従業員数 |
|---|---|---|
| ジーエヌアイグループ | 1122万円 | 9人 |
| アイロムグループ | 442万円 | 68人 |
| アンジェス | 1121万円 | 39人 |
| キッセイ薬品工業 | 758万円 | 1359人 |
| ナノキャリア | 708万円 | 17人 |
| そーせいグループ | 1345万円 | 32人 |
| ダイト | 491万円 | 743人 |
| コーア商事HD | 667万円 | 22人 |
| 田辺三菱製薬 | 846万円 | 4111人 |
| キッズウェル・バイオ | 737万円 | 41人 |
UMNファーマと平均年収が近い企業
| 企業名 | 平均年収 |
|---|---|
| 綜合臨床HD | 609万円 |
| 有機合成薬品工業 | 622万円 |
| LTTバイオファーマ | 611万円 |
| 廣貫堂 | 405万円 |
| ニプロ | 574万円 |
| オルバヘルスケアHD | 609万円 |
| ビオフェルミン製薬 | 575万円 |
| アドメテック | 522万円 |
| 薬王堂 | 405万円 |
| ファーマライズHD | 544万円 |
UMNファーマと売上高が近い企業
| 企業名 | 売上高 |
|---|---|
| ユリアインターナショナル | 1.27億円 |
| Nuts | 1.21億円 |
| イメージ情報開発 | 9962万円 |
| ジーエヌアイグループ | 2226万円 |
| MIEコーポレーション | 1.50億円 |
| クオンタムソリューションズ | 4800万円 |
| ITbookHD | 1.50億円 |
| ガーラ | 6719万円 |
| トライアイズ | 1.35億円 |
| セラーテムテクノロジー | 1.01億円 |