ステムリムの平均年収
ステムリムとは
| 企業名 | ステムリム |
|---|---|
| 本社所在地 | 茨木市彩都あさぎ7丁目7番15号 |
| 売上高 | 2298万円 |
| 社員数 | 44人 |
| 平均年収 | 667万円 |
| 推定初任給 | 31万円 |
| 年収偏差値 | 60.1 |
| 平均年齢 | 38.4歳 |
| 平均勤続年数 | 3.7年 |
有価証券報告書によるとステムリムの事業内容は次の通りです。
当社が創業以来、その実現を目指し研究開発に取り組んできた「再生誘導医薬」は、怪我や病気により損傷し機能を失った生体組織の機能的再生・治癒を促進する、唯一無二の新しい作用メカニズムに基づく医薬品です。
再生誘導医薬は、従来型の再生医療(※1)/細胞治療とは異なり、生きた細胞の投与を必要とせず、物質=医薬品の投与によって、患者自身の体内に存在する幹細胞(※2)を活性化する方法で、より簡便かつ安全に、治療効果の高い再生医療を実現します。再生誘導医薬により、細胞製剤では難しい安定した品質による迅速な再生医療を実現する製品供給が可能となることから、広く普及可能な新しい再生医療の実現が可能となり得ます。
再生誘導医薬の投与によって患者の体内で誘導される幹細胞は、血液循環を介して体内を巡り、損傷した組織に集積します。幹細胞は、神経や皮膚、骨、軟骨、筋肉、血管など、様々な種類の組織を構成する細胞に分化する能力を有するため、再生誘導医薬という共通のプラットフォームによって、脳梗塞、頭部外傷、筋萎縮性側索硬化症(ALS)や脊髄損傷などの中枢神経系疾患、心筋梗塞や心筋症などの循環器系疾患、難治性皮膚潰瘍などの上皮系疾患、慢性肝疾患や潰瘍性大腸炎などの消化器系疾患、難治性骨折や軟骨損傷などの骨格器系疾患、肺線維症などの呼吸器系疾患のように、多様な疾患に対して幅広い治療効果をもたらすことが期待されます。
(1)事業の内容
① 事業モデル
当社は、医薬品の研究開発を主たる業務としております。自社研究若しくは大学等研究機関との共同研究を通じて、生体内における組織再生誘導メカニズム(※3)の解明と幹細胞の特性解析、幹細胞の制御技術(※4)に関する基礎研究を行い、その成果を活用したスクリーニング(※5)系によって、新規再生誘導医薬シーズ(※6)の探索を行っております。
同定した候補物質については、自社単独若しくは共同研究を実施した大学等研究機関と共同で特許を出願し、研究開発活動の果実である知的財産の構築を進めております。大学等研究機関と共同で出願した特許については、当社が独占的な実施権の許諾を受け、以後の製品化に向けた研究開発を当社主導で進めております。
候補物質については、自社若しくは大学等研究機関/パートナー企業と共同で、製造方法の開発、非臨床薬効薬理試験(※7)、安全性試験(※8)、初期臨床試験等(※9)までを実施し、医薬品開発の成功可能性と知的財産価値を高めたうえで、国内・海外の製薬企業に対して、製品の開発権、製造権、販売権等をライセンスアウトすることで、(a)契約一時金、(b)開発の進捗に応じて支払われるマイルストーン収入、(c)製品上市後に売上高の一定割合が支払われるロイヤリティ収入、(b)売上高に対する目標値を達成するごとに支払われる販売マイルストーン収入等を得る事業モデルを採用しております。
また、パートナー企業とは、ライセンス契約に至る前の比較的早期の研究開発段階において、将来のライセンス契約を前提とした共同研究契約を締結することもあります(事業系統図の(共同研究))。この場合、当社は、パートナー企業から(a)契約一時金、(d)共同研究収入を得ることで、自社の費用負担を低減しつつ、かつパートナー企業の開発リソースも活用することで、研究開発を加速できるメリットを得られます。
このほか、研究進捗に応じてパートナー企業に対し研究データの使用権を許諾した際に収受する一時金等、(e)その他の一時金収入が発生する可能性があります。
当社の事業セグメントは、再生誘導医薬事業のみの単一セグメントであり、事業の系統図及び事業収入の形態は以下のとおりであります。
(事業系統図)
(事業収入の形態)
| 収入形態 | 内容 |
a. | 契約一時金 | 共同研究やライセンス許諾の契約時に一時金として得られる収入 |
b. | マイルストーン収入 | 医薬の開発段階毎に設定した目標(開発マイルストーン)を達成するごとに得られる一時金収入。また、製品上市後に、売上高に対する目標値(販売マイルストーン)を達成するごとに得られる一時金収入 |
c. | ロイヤリティ収入 | 製品が上市された後に、ライセンス許諾の契約を締結した製薬会社より当該製品の売上高に対して予め契約によって設定した一定割合を得られる収入 |
d. | 共同研究収入 | 当社の知的財産を活用した共同研究の実施の対価として得られる収入 |
e. | その他一時金 | 研究データ使用権の許諾等により得られる(a)以外の一時金収入 |
② 再生誘導医薬について/新しい再生医療
「再生誘導医薬(Stem cell Regeneration-Inducing Medicine)」とは、生きた細胞や組織を用いることなく、医薬品(化合物)の投与のみによって、再生医療と同等の治療効果を得られる医薬品です。
これまでは、怪我や病気で身体の臓器や組織に大規模な損傷や不可逆的な病変による機能不全が生じた場合、一般的な医薬品によってこれを根治することは難しく、その回復には、正常な臓器と取り換える移植医療(心臓移植や腎臓移植等の臓器移植や輸血等)を行う他に方法がありませんでした。しかしながら、このような移植医療は、難治性疾患に対する根治療法となり得る一方で、臓器提供者(ドナー)の慢性的な不足と他人の臓器に対する免疫拒絶(※10)反応、また倫理的な問題等から、すべての患者が享受できる、広く普及可能な一般医療にはなり得ません。
この移植医療の限界を突破する技術として、近年注目を集めているのが再生医療/細胞治療です。再生医療/細胞治療は、患者本人若しくは健常なドナー(提供者)から採取した細胞を、生体外で大量に培養することで、治療に必要な十分量の移植用細胞を確保したうえで患者に移植する新しい移植医療技術です。この再生医療/細胞治療は、従来の移植医療が抱える普及への制約を解消し、かつ同等な治療効果を得ることが期待できる新しい医療と言えます。
しかしながら、この再生医療/細胞治療についても、その実用化に向けては数多くの解決すべき課題があります。
再生医療/細胞治療は、最終製品として生きた細胞自体を用いる必要があることから、①製造工程における品質管理の難しさ(均質な細胞製剤を安定的に製造することが難しい)、②安全性への懸念(生体外で大量培養する工程で細胞が変質・癌化するリスクがある)、③治療可能時期の制約(自家の細胞を治療に用いる場合、採取から十分量の移植細胞を得るまでに数週間におよぶ細胞培養期間が必要となり急性期~早期治療の機会は失われる)、④免疫拒絶反応(他人から提供された細胞を培養して治療に用いる場合、免疫拒絶の問題が生じる)、⑤保管・流通の制約(冷凍・冷蔵により細胞を生きたまま運搬・保存する際に非常に手間がかかり、保存期間も限られる)など、数多くの構造的な課題を抱えており、一般医療として普及するためには更なる技術革新が必要な状況にあります。
このような背景のもと、当社が大阪大学との共同研究を通じて先駆的な概念を構築し開発を進めてきた「再生誘導医薬」は、製品として生きた細胞を一切用いることなく、『物質(化合物)の投与によって、再生医療/細胞治療を実現する』をコンセプトとする、新しい『再生医療』であります。
再生誘導医薬は、下図に示す作用メカニズムによって、損傷した組織の再生を実現します。
(再生誘導医薬のコンセプト)
1) 静脈注射等で血液中に再生誘導医薬を投与する。
2) 当該医薬品により患者自身の体内に存在する幹細胞、特に骨髄内に存在する間葉系幹細胞(※11)を刺激し、幹細胞を血液中に放出させる。
3) 骨髄から血液中に放出された間葉系幹細胞は、末梢血循環を介して身体中に運ばれ、損傷により低酸素状態になった組織から放出される特有の化学物質(ケモカイン(※12))を目印に患部に集積する。
4) 患部に集積した間葉系幹細胞は、抗炎症作用を発揮し損傷部位の炎症を鎮め、かつ組織の線維化(瘢痕形成)(※13)を抑制しながら、幹細胞の多分化能(※14)を発揮することで、行き着き生着した組織の環境に応じた、適切な種類の細胞に分化を遂げ、損傷した組織の機能的な再生を促進する。
体外で培養し加工した細胞を用いず、医薬品の投与によって患者自身の体内で間葉系幹細胞の集積誘導による再生医療を実現する再生誘導医薬は、従来型の再生医療が抱える数多くの課題を克服する、革新的な再生医療技術であります。
<細胞治療と比較した場合の再生誘導医薬のメリット>
(ⅰ)品 質: 工業生産可能な化合物医薬品であり品質管理された安定した製造が可能
(ⅱ)安 全: 生体外における細胞培養の工程がないため、細胞や培養液などの材料に由来する不純物による免疫反応、細胞を汚染しているウイルスやバクテリアによる感染症、細胞を培養する過程で生じる細胞の腫瘍化や癌化などのリスクがない
(ⅲ)供 給: 細胞とは異なり、原材料の供給が容易く、製造・保管・管理も容易。従来の医薬品と同じく医療機関(病院、薬局等)に常備しておき、必要な時にいつでも投与が可能。そのため、急性期治療(※15)への利用が可能
(ⅳ)免疫拒絶: 投与するのは本人の幹細胞を動員する化合物医薬品であり、他人の細胞を利用しないため、投与される細胞に対する免疫拒絶がない
(2)研究開発の経緯
■ 骨髄間葉系幹細胞の損傷組織への集積による体内組織再生誘導メカニズムの発見
再生誘導医薬開発の発端は、大阪大学で進められていた遺伝性皮膚難病「栄養障害型表皮水疱症(以下、「表皮水疱症(※16)」という。)」の病態解明研究から得られた「骨髄由来間葉系幹細胞の損傷組織への集積による組織再生誘導メカニズム」の発見にあります。
当時既に、損傷臓器・組織の再生はそれぞれの臓器・組織に存在する“組織幹細胞”に依存していることは良く知られていました。しかし、表皮水疱症の患者では、皮膚の最外層にある表皮組織の接着に必要な7型コラーゲンが遺伝的に欠損しているため、生まれた直後から全身皮膚の表皮剥離を繰り返し(図1参照)、その結果、表皮内に存在する“表皮幹細胞”が大量に失われてしまいます。表皮幹細胞を失った表皮水疱症の患者は、剥離した表皮を再生できないと容易に予想されます。しかし、患者の表皮は再生能力を維持しているという診療上の観察事実から、骨髄から血液を介した皮膚への幹細胞補充メカニズム仮説が想起されました。
図1
骨髄と各臓器は血管を介して繋がっています。例えば、骨髄から血液に供給された赤血球は全身全ての臓器・組織に酸素を供給し、白血球は免疫作用を、血小板は止血作用を供給しています。その意味において、表皮水疱症の患者の皮膚に生体内で幹細胞が補充されるのだとしたら、血液を介して骨髄から補充されるのではないかという仮説は妥当に思われます。その後、当社創業者でもある大阪大学教授の玉井らによりその仮説が証明されました(出典:Am J Pathol 2008 Sep;173(3)803-14, PNAS 2011 Apr 19;108(16):6609-14,J Immunol. 2015 Feb 15;194(4):1996-2003)。即ち、壊死した表皮細胞の核から放出されたHMGB1蛋白が、骨髄内の“間葉系幹細胞”と名付けられた組織再生能力の高い幹細胞を刺激して血中へと動員すること、HMGB1蛋白により血中へと動員された間葉系幹細胞は表皮水疱症皮膚の壊死組織周囲にある血管内皮細胞が産生するケモカインSDF-1α(※17)の作用により壊死組織周囲に集積すること、壊死組織周囲に集積した骨髄由来間葉系幹細胞は、強い抗炎症作用、抗線維化作用、組織再生促進作用を発揮することにより、表皮水疱症の剥離表皮再生を誘導していることが明らかとなりました(図2参照)。
図2
HMGB1蛋白は生体内のあらゆる細胞の核内に存在していることから、これら壊死組織と骨髄間葉系幹細胞のクロストークによる組織再生誘導メカニズムは、皮膚のみならず、生体内のあらゆる臓器・組織の重度壊死性障害において、その再生誘導メカニズムとして作動していると考えられます。
■ HMGB1蛋白の再生誘導医薬としての可能性と想定されたリスク
HMGB1蛋白は、生体内の全ての細胞の核内に存在し、DNAと結合して遺伝子発現を制御する核蛋白であることが40年以上前から知られていました。上述したHMGB1蛋白の骨髄間葉系幹細胞動員活性による組織再生誘導メカニズムの発見は、HMGB1蛋白を静脈内投与して血液中の間葉系幹細胞を人為的に増加させ、その抗炎症作用、抗線維化作用、組織再生促進作用により機能的組織再生を促進する、いわゆる再生誘導医薬としての可能性を生み出しました(出典:Sci Rep. 2015 Jun5;5:11008)。
一方、損傷組織で壊死細胞から細胞外に放出されたHMGB1蛋白は、ヒストンやDNA、あるいは細菌・ウイルス由来因子(※18)と結合すると好中球やマクロファージ(※19)を活性化し、炎症反応を誘導することが近年明らかにされました。即ち、細胞外のHMGB1蛋白は壊死組織や感染組織において自然免疫を活性化し、壊死組織や感染組織除去反応を誘導すると共に、それに続く組織再生反応を活性化する極めて重要な生体内分子であると言えます。しかし、敗血症のような重篤な感染症では、HMGB1蛋白が細菌由来LPS(※20)と血中で結合して全身性に強い病的炎症反応を喚起することが報告されています。これらの事実は、HMGB1蛋白を医薬として静脈内投与した際に、重度な感染症を合併している患者では局所性あるいは全身性に強い炎症反応を喚起してしまうリスクがあることを示しています。
■ 安全性の高いHMGB1ペプチド医薬の開発
HMGB1蛋白はA-box及びB-boxと呼ばれる二つのDNA結合ドメイン(※21)を持ち、炎症反応を誘導する自然免疫活性化ドメインはB-box内に存在することが明らかにされていました。(出典:J Intern Med. 2004 Mar;255(3):351-66.)これらの事実を背景として、当社は大阪大学と共同でHMGB1蛋白の骨髄間葉系幹細胞活性化ドメイン(以下、「KOI2ドメイン」という。)の探索を進め、KOI2ドメインはA-box内に存在することを明らかにしました。即ち、自然免疫活性化ドメインを含まないKOI2ドメインの化学合成ペプチド(HMGB1ペプチド、一般名:レダセムチド、以下、「レダセムチド」という。)は、炎症反応を喚起せずに間葉系幹細胞動員活性のみを持つ、安全性の高い再生誘導ペプチド医薬となることが期待されました。
大阪大学よりHMGB1蛋白及びレダセムチドの独占的実施権を得た当社は、大阪大学及び塩野義製薬株式会社のそれぞれとレダセムチド創薬の共同研究を推進し、表皮水疱症、脳梗塞、心筋梗塞、虚血性心筋症、拡張型心筋症、脊髄損傷といった、現在有効な治療法の無い難治性疾患の動物モデルにレダセムチドの静脈内投与が有効であること、炎症反応は全く喚起されないことを証明し、医薬特許取得を精力的に進め、レダセムチド医薬開発権を塩野義製薬株式会社にライセンスいたしました。
また、ヒトでの安全性及び有効性を確認する目的で行われた、大阪大学における健康成人を対象としたレダセムチド第Ⅰ相医師主導治験では、レダセムチドの安全性及び間葉系幹細胞血中動員活性が証明されました。
現在、栄養障害型表皮水疱症において第Ⅱ相医師主導治験追加試験の準備中、脳梗塞、変形性膝関節症、慢性肝疾患において第Ⅱ相治験が実施中、心筋症において第Ⅱ相試験の準備中となっております。各研究開発進捗の詳細は、「第2 事業の状況 3 経営者による財政状態、経営成績及びキャッシュ・フローの状況の分析(1)経営成績等の状況の概要 ① 経営成績等の状況」をご参照ください。
■ 第2世代再生誘導医薬の開発
上述したように、骨髄内に存在する間葉系幹細胞は生体内の壊死細胞が放出するHMGB1蛋白の血中濃度上昇を感知して活性化し、末梢循環を介して壊死組織周囲に集積して組織再生を促進していることが明らかとなりました。これらの発見から、HMGB1蛋白以外の壊死細胞由来因子にもHMGB1蛋白と同様の骨髄間葉系幹細胞活性化作用、組織再生誘導作用がある可能性が想起されました。そこで当社は、大阪大学と共同で壊死細胞から血中放出される可能性のある生体内蛋白を網羅的に探索し、その活性ドメインペプチドの骨髄間葉系幹細胞活性化作用を評価することにより、レダセムチドと同等あるいはそれ以上の骨髄間葉系幹細胞活性化作用を持つ生体内物質を複数同定いたしました。現在、当社はこれらの第2世代再生誘導医薬候補物質の疾患モデル動物に対する薬効評価を進めています。
(3)技術の優位性
間葉系幹細胞を利用した細胞治療が、様々な疾患に対して行われているのは、間葉系幹細胞が有する、様々な細胞種に分化する能力(分化能力)、サイトカイン(※22)・ケモカイン・成長因子(※23)を分泌する能力(トロフィック能力)、免疫応答(※24)を調整する能力(免疫調整能力)、損傷組織に遊走する能力(細胞遊走能力(※25))、線維化を調整する能力(線維化調整能力)があるためと考えられています。(図3参照; Cell Transplantation, Vol. 25, pp. 829–848,2016より引用。図の一部改変。出典:Nat Immunol. 2014 Nov;15(11):1009-16, Stem Cell Trans Med. 2012 Feb;1(2):142-9)
図3
すなわち生体内においては、組織や臓器に損傷を受けると、細胞レベルのダメージを生じ、不可逆的な障害を受けた細胞は壊死します。更に、傷口から侵入した細菌などを制御する他、壊死した細胞を除去するために、損傷組織には受傷直後から炎症細胞が集まります。間葉系幹細胞は血流を介し損傷組織まで遊走し(細胞遊走能力)、免疫反応を調節し、過剰な炎症による組織損傷の拡大を抑えます(免疫調整能力)。また、損傷組織の細胞に対し成長因子やサイトカインを分泌することで、細胞の増殖や組織の修復を促進します(トロフィック能力)。更に、間葉系幹細胞自身が、様々な種類の細胞に分化することによって(分化能力)、間葉系幹細胞由来の細胞が損傷組織の細胞に置き換わり組織を再生します。このような間葉系幹細胞の能力は、様々な組織や臓器の再生で効果を発揮するため、多種多様な疾患に対して間葉系幹細胞を細胞治療や再生医療に利用することができると考えられます。
一方で次のような課題も存在します。
・ES細胞、iPS細胞
[生命倫理上の課題(ES細胞)]
ES細胞はヒトの生命の萌芽である胚を破壊して作る必要があるため、倫理的課題があります(参考文献:ヒトES細胞の樹立に関する指針平成31年文部科学省・厚生労働省告示第4号)。更に近年では、ES細胞のように多能性を有しほぼ無限に増殖可能なiPS細胞が発明され、また、iPS細胞は受精卵を利用せず本人の細胞から作成することが可能であるため、倫理的課題のみではなく免疫拒絶についても解決に向けて大きく前進しました。
[細胞の安全性の課題と医療コストの課題(ES細胞、iPS細胞)]
ES細胞もiPS細胞も無限に増殖するため、増殖の過程で生じる遺伝子の変異や癌化のリスクに対応をする必要があります。
・その他の細胞
ES細胞やiPS細胞を使用しない、幹細胞を使用した再生医療/細胞治療としては、自家細胞(自己の細胞=患者本人の細胞)を利用するものと他家細胞(他人の細胞)を利用するものがあります。表皮細胞、筋芽細胞、軟骨細胞、間葉系幹細胞など様々な細胞が再生医療、細胞治療に使用されています。
[自家細胞の課題]
自家細胞では、患者本人から採取した細胞を培養し増殖、加工し使用します。他人の細胞を使用しないので、感染症や免疫拒絶のリスクを最小限に抑えることができますが、一人の患者から採取できる細胞の量に限界があります。また、ES細胞やiPS細胞とは違い細胞を無限に増殖させることができないため、治療に十分な細胞を用意することが課題となります。また、オーダーメイドで作成する必要があるため、急性期の治療が困難で、治療費が高額になるという課題があります。
[他家細胞の課題]
他家細胞では、多数のドナーから細胞の提供を受け、細胞バンクに細胞を保存しておくことで、急性期の治療にも対応でき、医療コストも抑えることができますが、ドナーに由来する未知の感染症や免疫拒絶のリスクがあります。(参考文献:経済産業省「再生医療の実用化・産業に関する研究会」の最終報告書)
[間葉系幹細胞の課題]
ほぼ無限に増殖することが可能なES細胞やiPS細胞とは異なり、間葉系幹細胞が増殖する能力には限界があります。間葉系幹細胞は、細胞分裂を繰り返す過程で細胞の老化現象(senescence)を起こし、分化能力や免疫調整能力や細胞遊走能力という細胞治療の効果に寄与する重要な能力が失われることが知られています。このため、間葉系幹細胞を使用した医療を広く行うためには、継続的に大量の細胞を供給する必要があります。すなわち、多数のドナーの骨髄から細胞を採取し、大量の細胞を確保しなければならず、一般的な医療とするためには、原材料の供給の面で課題があると言えます。(出典:Stem Cells Transl Med. 2017 Dec;6(12):2173-2185.)
[細胞を利用する再生医療や細胞治療の課題]
このように、再生医療や細胞治療は、これまでにない新しい医療で、従来の医療では治療困難な疾患に対して優れた治療効果があるものの、既存の医薬品と異なり生きた細胞を治療用に使用するため、従来の医薬品では問題にならなかった、様々な課題を解決する必要があります。(参考文献:平成26年度「再生医療の産業化に向けた評価基盤技術開発事業」原料細胞の入手等に関する調査等報告書)
■ 再生誘導医薬(当社シーズ)による課題の解決
再生誘導医薬は、生体内に存在する骨髄間葉系幹細胞を損傷組織へ動員する、生体が元来有する治癒能力を促進する医薬です。損傷組織を直接治療するのは、薬剤の投与によって損傷組織に動員された間葉系幹細胞であるため、間葉系幹細胞の特徴である、細胞遊走能、免疫調整能、トロフィック能、線維化調整能、組織再生能等によって一つの物質で広範な疾患領域に対する適応が期待できます。また、投与するのはペプチド、タンパクなどの物質であり、従来の医薬品と同じ方法で製造、輸送、保管、投与が可能です。そのため、再生医療や細胞治療の様々な課題を解決しながら、従来の医療では治療困難であった疾患を治療のターゲットとすることができます。
図4
(4)当社技術のターゲットとなる適応症
間葉系幹細胞を使用した細胞治療で効果が期待できる疾患領域や病態が治療のターゲットとなります。以下のように広い疾患領域や様々な病態が適応症として期待できます。
図5
(5)パイプラインの概要
当社の手掛ける研究開発パイプラインとその進捗状況は以下のとおりであります。パイプラインは、以下5つのプロジェクト(PJ1~PJ5)に分類されます。
※ PJ1-01について、対象となる栄養障害型表皮水疱症は、全国の患者数がに400名前後と推定される希少難治性疾患であり、大規模な第Ⅲ相試験を計画することが困難であるとともに現在有効な治療法がありません。したがって、当社としては、追加第Ⅱ相試験の結果を踏まえ、医薬品の承認申請を行うことを見込んでおります。
※ PJ4-01について、第Ⅰ相試験以降は、現在、実施しない方向で調整中ですが、未確定のためNDと記載しております。
各パイプラインの主な市場ターゲットは、日本、アジア圏(中国、韓国等)、米国、欧州などです。
各パイプラインの概要は、以下のとおりです。
PJ1 再生誘導医薬 レダセムチド (HMGB1ペプチド) | 概要 | 生体内タンパク質HMGB1の生理活性ドメインから創生したペプチド製剤(※26)です。静脈内投与により患者の骨髄内間葉系幹細胞を末梢血中に動員し、損傷部位に集積させることで、患部の組織再生と治癒を促進します。間葉系幹細胞を介した治療メカニズムにより、組織損傷を伴う幅広い疾患が適応症となります。これまでに実施した疾患モデル動物を用いた非臨床薬効試験で、脳梗塞、心筋梗塞/心筋症、表皮水疱症、難治性皮膚潰瘍、脊髄損傷、筋萎縮性側索硬化症(ALS)、外傷性脳損傷、潰瘍性大腸炎等に対する良好な治療効果を確認しています。 |
開発 | 最も先行する表皮水疱症(PJ1-01)については、第Ⅱ相試験の追加試験実施中であります。脳梗塞(PJ1-02)については、第Ⅱ相試験において、レダセムチドの有効性が確認され、現在、グローバル第Ⅲ相試験の準備中であります。変形性膝関節症(PJ1-04)、慢性肝疾患(PJ1-05)については、第Ⅱ相臨床試験が進められています。心筋梗塞/心筋症(PJ1-03)については、大阪大学において臨床試験(第Ⅱ相試験)相当の開始に向けた準備が進められています。 | |
提携 | PJ1については、2014年11月に塩野義製薬株式会社との間にライセンス契約を締結しております。当社は、既に受領済みの契約一時金及びマイルストーン収入に加え、今後の開発の進捗に応じたマイルストーン収入及び製品上市後のロイヤリティ収入及びマイルストーン収入を得ることができます。 |
PJ2 再生誘導医薬新規 ペプチド | 概要 | 大阪大学と共同で、新規に開発したスクリーニング法によって発見した、静脈内投与により末梢血中の間葉系幹細胞を増加させる作用を有するペプチドです。PJ1と同じく、組織損傷を伴う幅広い疾患に対する再生誘導治療薬となることが期待されます。生体由来のペプチドの他、生体由来活性ペプチドの情報を基に作成したペプチドの開発も行っています。 |
開発 | これまでのスクリーニングから10種類以上の候補ペプチドを保有しており、治療効果の高いものから順次開発を進めていく計画です。現時点で、3つの候補ペプチドについて、臨床試験の開始までに必要となる非臨床試験を実施しております。これまでの動物実験により良好な間葉系幹細胞血中動員作用を確認しており、現在、複数種類の疾患モデル動物を用いた薬効試験を行い、最適な開発対象疾患の選定を進めております。 | |
提携 | PJ2については、GLP非臨床毒性試験(※27)~早期臨床試験(※28)の段階まで自社で開発を進め、その後、製薬企業にライセンスアウトする方針であり、現時点において、商業化(開発・製造・販売等)に係る権利は、すべて当社が保有しております。 |
PJ3 生体由来再生誘導 タンパク | 概要 | 生体組織から抽出された生体内タンパク質に由来するタンパク質製剤です。静脈内投与若しくは局所投与により、生体内の間葉系幹細胞を効率よく患部に集積させる作用を有しており、組織損傷を伴う幅広い疾患に対する治療薬となることが期待されます。 |
開発 | これまでに得られた複数の候補タンパクの中から、最も治療効果の高いものを選定し、開発を進めていく計画です。これまでの動物実験で良好な間葉系幹細胞集積作用を確認しており、複数種類の疾患モデル動物による薬効試験によって、最適な適応症の選定を進めております。 | |
提携 | PJ3については、GLP非臨床毒性試験~早期臨床試験の段階まで自社で開発を進め、その後、製薬企業にライセンスアウトする方針であり、現時点において、商業化(開発・製造・販売等)に係る権利は、すべて当社が保有しております。 |
PJ4 治療用自己細胞 採取デバイス | 概要 | 幹細胞誘引物質を用いて患者体内の間葉系幹細胞を回収し、これを患部に移植することで組織の再生治療を行う再生誘導医療デバイス(※29)です。生体内埋没型デバイスに、当社が見出した間葉系幹細胞を誘引する物質を含ませたうえで患者の皮下に一定期間埋め込み、このデバイスに集積した患者自身の間葉系幹細胞を収集し治療に用います。間葉系幹細胞移植が治療効果を発揮することが報告されている幅広い疾患に対して有効な医療デバイスとなることが期待されます。 |
開発 | まず、骨・軟骨損傷を伴う疾患、難治性皮膚潰瘍等に対する医療デバイスとしての開発を計画しております。これまでの動物実験で当デバイスが良好な幹細胞回収能力を有することを確認しており、複数種類の疾患モデル動物による薬効試験によって、最適な適応症の選定を進めながら、臨床試験の開始までに必要となる非臨床試験を実施しております。 | |
提携 | PJ4については、非臨床毒性試験~早期臨床試験段階まで自社で開発を進め、その後、製薬企業や医療機器メーカー等にライセンスアウトする方針であり、現時点において、商業化(開発・製造・販売等)に係る権利は、すべて当社が保有しております。 |
PJ5 幹細胞遺伝子治療 | 概要 | 遺伝子欠損等に起因する重度の遺伝性疾患に対しても再生誘導医療を可能にする治療技術です。当社がこれまでに培った独自の幹細胞培養・調整技術を駆使し、患者自身の幹細胞に対して体外で遺伝子編集を施し、欠損/変異した遺伝子を補ったうえで患者の体内に戻す、根治的再生誘導型細胞治療製品(※30)です。 |
開発 | 初めの適応症として、遺伝子完全欠損型の重度表皮水疱症を対象に開発を進める計画です。遺伝子編集技術を用いて正常遺伝子を組み込んだ間葉系幹細胞を動物に移植する実験により、移植を受けた動物体内に目的タンパク質(7型コラーゲン)が十分量安定的に産生されることを確認しており、想定する作用機序(※31)が機能することを証明しております。現在、疾患モデル動物による薬効試験など臨床試験の開始までに必要な非臨床試験を追加実施しております。 | |
提携 | PJ5については、非臨床毒性試験~早期臨床試験段階まで自社で開発を進め、その後、製薬企業や医療機器メーカー等にライセンスアウトする方針であり、現時点において、商業化(開発・製造・販売等)に係る権利は、すべて当社が保有しております。 |
(a)PJ1 再生誘導医薬レダセムチド(HMGB1ペプチド)
① PJ1-01 表皮水疱症治療薬
(適応症:表皮水疱症(栄養障害型)について)
皮膚は、表皮(E)と真皮(D)からなる2層の構造をとっています。表皮もまた体の外側から角層(①)、有棘層(②)、基底層(③)と層構造をとっています(図6参照)。基底層には表皮細胞の幹細胞(表皮幹細胞)が存在します。幹細胞から分裂した未分化な表皮細胞は次第に分化して体の外側へと移動します。一番外側まで移動すると、角質となって体のバリアーを形成し体内の水分を保持するほか、外界からの刺激やバクテリアなどの感染症から体の内部を守っています。表皮の直下にある真皮は1型コラーゲンという蛋白を主成分とする組織で皮膚に物理的な強さを与えるほか水分を保持しています。
図6
皮膚は特殊な『糊』によって表皮と真皮がしっかりと接着しています。強い機械的刺激でも表皮が皮膚からはがれることはありません。表皮と真皮を接着させる『糊』の役割をしているのが、表皮細胞や真皮に存在する線維芽細胞から分泌される7型コラーゲンと呼ばれるタンパクです。7型コラーゲンに異常があると『糊』としての機能が低下して表皮と真皮を接着する力が弱くなり、弱い刺激であっても表皮が真皮からはがれてしまいます(図7参照)。
はがれた表皮と真皮の間には組織液がたまり水ぶくれ(水疱)が生じます。水疱が破れると潰瘍となり、治癒が追い付かずに傷が遷延化(※32)すると、瘢痕化(線維化)し皮膚がひきつれるために関節などが動かないようになってしまいます。
表皮水疱症の患者は7型コラーゲンの遺伝子に異常があるため、機械的刺激により容易に表皮と真皮の間が裂けます。その結果出生時から全身の皮膚に水ぶくれができ、生涯にわたり症状が続きます。遺伝子治療をのぞいて現時点で根治的な治療法はありません。
図7
前述のように、表皮水疱症では、表皮が剥離する際に表皮幹細胞が失われてしまうため、新しい表皮を再生することが困難な状態になります。骨髄間葉系幹細胞は皮膚に集積することによって、細胞成分や7型コラーゲンを供給します。病因である7型コラーゲンの異常があるため、完治はできませんが、難治性皮膚潰瘍などの症状の改善が期待できます。
② PJ1-02 脳梗塞治療薬
(適応症:脳梗塞について)
脳梗塞は、主に脳に酸素や栄養を供給する血管が血栓によって閉そくすることが原因で生じる疾患です。脳は低酸素状態に極めて弱く、また一度障害を受けると再生をすることが極めて困難な臓器であるため、これまで有効な治療はほとんどありませんでした。血栓を溶解させる薬(血栓溶解剤)が有効ですが、発症初期の数時間後までにしか使用できないため、一部の患者にしか投与されていません。血栓溶解剤を投与できなかった場合や投与されても十分な効果が得られなかった場合、脳梗塞によって生じる麻痺などの治療はリハビリテーションなどによって行われています。骨髄間葉系幹細胞による細胞治療は、免疫寛容効果による炎症の抑制や、トロフィック効果による組織再生を期待されています。しかし、患者本人の骨髄間葉系幹細胞を利用する場合、細胞採取の後、細胞培養による増殖工程にかかる時間が必要であり、発症後すぐに患者に投与することができません。また、高額な医療コストなどの課題があります。再生誘導医薬は、タンパクやペプチドなどの従来の医薬と同様に扱うことが可能であり、必要時にすぐに使用することが可能です。また、骨髄採取や細胞培養の設備が必要ないため、一般の病院においても治療を行うことが可能です。
③ PJ1-03 心筋症治療薬
(適応症:心筋症について)
心臓は全身の臓器に血液を送り出すポンプの役割を果たしています。心臓は心筋と呼ばれる筋肉でできていて心筋が伸びる際に血液を心臓に取り込み、心筋が縮む際に血液を心臓から送り出します。心筋症は、心筋が線維化などによって伸縮が不良になり心臓のポンプ機能が障害される疾患です。心筋症の原因は、心筋梗塞や狭心症などの虚血性心疾患、高血圧、アルコールの多飲等が知られていますが、これらの原因が明らかな心筋症を特定(2次性)心筋症とし、原因が不明な特発性心筋症とに区分されます。
④ PJ1-04 変形性膝関節症治療薬
(適応症:変形性膝関節症について)
変形性膝関節症は加齢、関節軟骨の変性、及び外傷後に生じる膝関節退行性疾患です。関節軟骨の摩耗により軟骨下骨への負荷が増大し、関節全体の構造変化を伴いながら慢性疼痛や歩行運動能力及びActivities of Daily Living (ADL) が低下することで,Quality of Life (QOL) が損なわれる疾患です。変形性膝関節症の治療法は保存的治療と手術に大別されます。保存療法は対症療法であり、摩耗した年骨を修復する根治療法ではないためその効果には限界があります。保存療法で効果が十分に得られない場合や、症状が強い症例では外科的治療が施行されます。この外科的治療として関節鏡手術、高位脛骨骨切り術、人工関節置換術等が行われています。日本人に多い内側型変形性膝関節症に対しては高位脛骨骨切り術がよい適応となりますが、その目的は下肢全体のアライメントを整えることで内側の過重負荷を軽減し残存軟骨を保護することであり、軟骨自体を修復するものではありません。人工関節置換術は骨変化や関節構造の破壊が進行した重症の変形性膝関節症に対し適応となっており、その件数は増加傾向にあります。
⑤ PJ1-05 慢性肝疾患治療薬
(適応症:慢性肝疾患について)
肝臓は、B、C型肝炎ウイルスなどに起因するウイルス性肝炎やアルコール性、非アルコール性脂肪性肝炎等生活習慣に起因する慢性肝障害によって、肝臓内に細胞外基質が過度に蓄積された線維化へと至ります。その進行した状態を肝硬変といい、肝機能低下、門脈圧亢進、発癌など様々な問題が生じ得る疾患です。
(b)PJ2 再生誘導医薬新規ペプチド
■ 骨髄間葉系幹細胞を骨髄内から血中に動員する薬(新規物質)
当社は骨髄間葉系幹細胞による損傷組織の再生や再生誘導物質を発見して以来、骨髄中に存在する間葉系幹細胞、血流中に存在する間葉系幹細胞、損傷組織に存在する間葉系幹細胞など生体に存在する自然の状態の細胞に注目し研究を続けてきました。それらの知見をもとに新たに開発した間葉系幹細胞血中動員活性のスクリーニング法と組み合わせることで再生誘導医薬の研究を加速しています。
以上のような基礎的な研究の結果、生体内に存在する骨髄間葉系幹細胞に対する新たな知見を積み重ね、新規骨髄間葉系幹細胞の血中動員新規合成ペプチド(RIM3)を得ることができました。
RIM3は潰瘍性大腸炎、アトピー性皮膚炎、脳梗塞の動物モデルにおいて症状の改善が認められております。
(c)PJ3 生体由来再生誘導タンパク
■ 骨髄間葉系幹細胞動員物質分泌促進剤
PJ1及びPJ2の開発品は、骨髄内の間葉系幹細胞を刺激して、骨髄から間葉系幹細胞を血中に動員する物質です。一方、PJ3では、損傷組織から間葉系幹細胞動員物質の分泌を増加させる物質を開発します。
レダセムチドとは作用メカニズムが異なるため、レダセムチドと併用若しくは単独で使用することによって、再生誘導医療の対象疾患の拡大が期待できます。特に、損傷組織が小さい病態においては、虚血領域も小さいため、低酸素状態で分泌量が増大するSDF-1αの量が少なく、間葉系幹細胞が損傷個所に集積できない恐れがあります。そのようなときに、本物質を患部周囲へ投与することで、循環血流中の間葉系幹細胞を治療する臓器に集積させる効果を狙います。
応用例としては、レダセムチド投与によって、末梢循環血流中に増加した間葉系幹細胞を、PJ3の開発品投与によって末梢循環血流中から損傷組織に効率的に集積させることが考えられます。
図8
(d)PJ4 治療用自己細胞採取デバイス
■ 自己の骨髄間葉系幹細胞をデバイス内に集積させ体外に回収後、損傷部位の細胞治療に利用する技術
骨髄間葉系幹細胞の動員因子をデバイス内に挿入し、皮下など生体内に埋没することで生体内に存在する細胞を直接回収する技術を開発しています。現在、実験動物を使用した非臨床の研究を行っており、良好な幹細胞回収効果を得ております。臨床の場面では、医師によって患者本人の皮膚に局所麻酔を行った後、数mmから数cmの皮膚切開をします。あらかじめ骨髄間葉系幹細胞の動員因子(※33)を挿入しておいたデバイスを、切開した皮膚から皮下に挿入します。挿入後数日経過した後にデバイスを体外に取り出し、デバイス内に集積した細胞を損傷組織(患部)に直接投与します。デバイスを挿入する手術も、外来通院にて施行可能な程度の簡単な手術となります(図9参照)。
図9
再生誘導医療デバイスの特徴は下表のとおりです。体外で培養する工程や細胞を加工する工程がないため、セルプロセッシングセンター(※34)が必要なく、細胞の製造、保管、輸送にかかわるコストを削減できるため、低コストで細胞治療を行うことができます。
間葉系幹細胞は様々な組織(神経系、循環器系、上皮系、間葉系)の疾患の治療に応用することができるため、本技術の治療対象は広範な領域となることが期待されます。
| 再生誘導医薬デバイス | 従来型の間葉系幹細胞を利用した再生医療、細胞治療 | |
細胞の提供元 | 自己の細胞 | 自己の細胞 | 他人の細胞 |
体外での培養の有無 | 無(自分の皮下から採取した細胞を直接使用する) | 有(セルプロセッシングセンターで培養する) | 有(セルプロセッシングセンターで培養する) |
免疫拒絶反の有無 | 無 | 無 | 有 |
医師による手術 | 必要 | 必要 | 必要 |
(e)PJ5 幹細胞遺伝子治療
■ 遺伝性疾患の患者本人の間葉系幹細胞を採取し、体外で病因となる遺伝子の修復を行う技術です。
一般に、遺伝子治療では病変臓器の幹細胞を治療対象とするため、疾患ごとに様々な臓器の幹細胞に対して遺伝子治療を施さなければなりません。ヒト間葉系幹細胞に正常な7型コラーゲンを遺伝子導入し、表皮水疱症モデルマウスの皮膚に細胞移植しました。その結果、ヒト由来の7型コラーゲンがマウスの皮膚で正常に機能していることが証明されました。間葉系幹細胞は、多分化能の他にも、免疫調節能などを有し、様々な疾患に対して治療効果を有するため、間葉系幹細胞を遺伝子治療の対象にすることにより、様々な遺伝性疾患に対する治療が期待できます。
図10
(6)再生誘導医療の可能性
再生誘導医療は、元来生体が持っている損傷組織の再生能力を、生体内に存在する幹細胞を体外で人工的に操作(培養や加工など)することなく、生体内で活性化することで、難治性の疾患の治癒を目指す医療です。現在、当社では、骨髄に存在する間葉系幹細胞を血中に動員する再生誘導医薬、血中に存在する間葉系幹細胞を損傷組織に集積する再生誘導医薬、血中に存在する間葉系幹細胞を皮下に埋めたデバイス内に集積させ細胞治療に利用する医療、間葉系幹細胞を標的とした遺伝子治療と細胞治療のハイブリッド医療の研究開発を行っています。
再生誘導医薬の場合、薬が患部に直接作用するのではなく、骨髄や血液などに存在する幹細胞に作用することが特徴です。患部を治療するのはあくまで生体に存在する活性化された幹細胞です。生体内に存在する幹細胞の理解を深めることで、再生誘導医療を発展させることが可能になります。
現在、日進月歩で幹細胞の研究が進んでおり、当社においても幹細胞の最新の知見をもとに、難治性疾患に対する新たな再生誘導医薬の開発を進めています。
(7)用語解説
No | 用語 | 解説 |
※1 | 再生医療 | (1) 患者の体外で人工的に培養した幹細胞等を、患者の体内に移植等することで、損傷した臓器や組織を再生し、失われた人体機能を回復させる医療 (2) 患者の体外において幹細胞等から人工的に構築した組織を、患者の体内に移植等することで、損傷した臓器や組織を再生し、失われた人体機能を回復させる医療 (3) 生きた細胞を組み込んだ機器等を患者の体内に移植等すること又は内因性(生体又は細胞の内部で生産される)幹細胞を細胞増殖分化因子(動物体内において、特定の細胞の増殖や分化を促進する内因性のタンパク質の総称)により活性化/分化させることにより、損傷した臓器や組織の自己再生能力を活性化することで失われた機能を回復させる広義の再生医療(←再生誘導医薬が該当する医療) (内閣府 総合科学技術会議基本政策推進専門調査会『失われた人体機能を再生する医療の実現』 (平成20年5月)参照) |
※2 | 幹細胞 | 自己複製能と分化能をあわせもつ細胞。自己複製能とは体細胞分裂を経て形成される2つの娘細胞のうち、少なくともひとつに親細胞である幹細胞と同等の自己複製能と分化能が賦与されることをいう。また、分化能とは、体細胞分裂を経て形成される娘細胞が、最終的に少なくとも1種類の、親細胞である幹細胞とは異なる表現型を有する細胞になることをいう。(引用文献 蛋白質 核酸 酵素 Vol.51 No.11 (2006)) |
※3 | 組織再生誘導 メカニズム | 骨髄内に存在する間葉系幹細胞が循環血流を介して損傷組織へ集積する現象の発見の結果、再生誘導医薬であるレダセムチドの発明につながった。生体内における組織再生誘導の原理(組織再生誘導メカニズム)を明らかにすることによって、新たな再生誘導医薬の開発が期待できる。 |
※4 | 幹細胞の制御技術 | 幹細胞は、生体内における環境や培養条件などによって容易に性質を変化させ、幹細胞(自己複製能、分化能)としての性質を失ってしまう。そこで、幹細胞を維持するための細胞制御技術は必須の技術である。また、幹細胞が分化しながら組織再生に必要な機能を付与されるためには、適切な分化制御が必要になる。このように、再生医療や再生誘導医薬の開発のために、幹細胞の制御技術の開発は必須である。 |
※5 | スクリーニング | 有効な化合物を選定するために、種々の評価系を用いて多くの化合物を評価すること。 |
※6 | 再生誘導医薬シーズ | 再生誘導医薬として事業化・製品化が可能な、技術、ノウハウ、アイデア、化合物など。 |
※7 | 非臨床薬効薬理試験 | 動物を使用し物質の効果を評価する試験。 |
※8 | 安全性試験 | 物質の毒性の有無等を評価する試験。 |
※9 | 臨床試験 | 臨床現場でヒトを対象に行う試験であるが、ここでは医薬品の承認を受けるためのいわゆる治験をいう。治験は、一般的に以下の段階を経て行われる。 ・第Ⅰ相試験(フェーズ Ⅰ)… 少数の健常成人を対象とし、候補薬の安全性や薬がどのように体内で吸収、分布、代謝され排泄されるか、などを調べる。 ・第Ⅱ相試験(フェーズ Ⅱ)… 少数例の患者を対象に、有効性・安全性・適切な投与量などの検討を行う試験。 ・第Ⅲ相試験(フェーズ Ⅲ)… 多数の患者を対象に、実際の医療に近い形で有効性や安全性を確認することを目的とし、比較対照試験などを含めて行われる。 |
※10 | 免疫拒絶 | 人体はウイルスやバクテリアなど異物が体内に侵入した際に排除する免疫がある。同様に治療を目的として他人の細胞や臓器を移植する際にもそれらを異物と認識し排除すること。 |
※11 | 間葉系幹細胞 | 生体内では、骨髄、さい帯、胎盤、脂肪、筋肉、胸腺、歯髄中といった成体組織において発見されており、生体内に存在する一般的な組織幹細胞とは異なり、多分化能を持つと考えられている。(ギルバート発生生物学10版参照)通常、成体に存在する間葉系幹細胞は、他の間葉系の細胞と同じように中胚葉由来と考えられていたが、少なくとも胎児期には外胚葉由来の間葉系幹細胞が存在することが明らかになっている。(Cell.2007 Jun 29;129(7):1377-88.参照) |
※12 | ケモカイン | 特定の白血球に作用し、濃度勾配の方向に白血球を遊走させる活性(走化性)を持つサイトカインの総称。 |
※13 | 線維化 (瘢痕形成) | 組織を構成している結合組織と呼ばれる部分が異常増殖する現象のこと。例えば、心筋に線維化が生じたときには心臓の働きに異常が起き、呼吸困難や心悸亢進(動悸)などの症状が出る。また関節リウマチにおける骨の萎縮や変性、肝臓全体の線維化を示す肝硬変の病態なども、結合組織が線維化した例である。 |
No | 用語 | 解説 |
※14 | 多分化能 | 様々な細胞に分化する能力。多細胞生物においては、細胞が様々な特化した機能を持つ細胞へと変化(分化)し、複雑なシステムを作り上げていく。 |
※15 | 急性期治療 | 症状が急激にあらわれる時期、病気のなり始めの治療。 |
※16 | 表皮水疱症 | 表皮水疱症は、表皮~基底膜~真皮の接着を担っている接着構造分子が生まれつき少ないか消失しているため、日常生活で皮膚に加わる力に耐えることができずに表皮が真皮から剥がれて水ぶくれ(水疱)や皮膚潰瘍を生じてしまう病気。特に、7型コラーゲンの遺伝子異常によって、基底膜と真皮の間で剥がれる病型を栄養障害型表皮水疱症と呼ぶ。 |
※17 | (ケモカイン) SDF-1α | SDF(Stromal Derived Factor)-1αはケモカインCXCファミリーの一種。リンパ球の強力な化学誘引因子であり、リンパ球を新しく形成した血管へ補充、胎児と成人両方の生体の血管新生に関与する。低酸素状態の血管内皮細胞などで発現が亢進する。 |
※18 | 因子 | 現象や機能の原因を因子と呼ぶが、生化学で原因が物質として特定された場合にはその物質も因子という。 |
※19 | 好中球や マクロファージ | 白血球の一種。遊走運動を行い、細菌などの異物を捕食する。炎症初期には好中球が炎症部位に集まり、細菌類を貪食殺菌する。後期になるとマクロファージが集まり死んだ細胞や細菌を食作用により処理、分解する。 |
※20 | LPS | リポ多糖、Lipopolysaccharide。グラム陰性菌細胞壁外膜の構成成分であり、脂質及び多糖から構成される物質(糖脂質)である。LPSは内毒素(エンドトキシン、英: Endotoxin)であり、ヒトや動物など他の生物の細胞に作用すると、多彩な生物活性を発現する。 |
※21 | (タンパク質) ドメイン | タンパク質の構造の一部で、固有の機能を持つ部分。 |
※22 | サイトカイン | サイトカイン(cytokine) は、細胞から分泌される低分子のタンパク質で生理活性物質の総称。生理活性蛋白質とも呼ばれ、細胞間相互作用に関与し周囲の細胞に影響を与える。 |
※23 | 成長因子 | 体内において、特定の細胞の増殖や分化を促進する内因性のタンパク質の総称。 |
※24 | 免疫応答 | 体内の抗原を察知し、排除する反応。 |
※25 | 細胞遊走 | 細胞がある場所から別の場所に移動すること。創傷治癒や胚の発生の過程などで重要な役割を担っている。 |
※26 | HMGB1の生理活性ドメインから創生したペプチド製剤 | 当社と大阪大学との共同研究でA-box内に存在することが明らかとなった、HMGB1蛋白の骨髄間葉系幹細胞活性化ドメイン(以下、「KOI2ドメイン」という。)。PJ1は当該KOI2ドメインの化学合成ペプチド(レダセムチド)の医薬品化を目的とするPJである。 |
※27 | GLP | GLP(Good Laboratory Practice)とは、医薬品の非臨床試験の安全性に関する信頼性を確保するための基準をいう。 |
※28 | 早期臨床試験 | 第Ⅰ相試験、初期第Ⅱ相試験などの臨床試験のこと。後期第Ⅱ相試験、第Ⅲ相試験など後期臨床試験に対する用語。 |
※29 | デバイス | 生体内から細胞を回収する治療用の装置。患者の皮下に埋め込んで用いることを想定している。 |
※30 | 根治的再生誘導型 細胞治療製品 | 再生誘導医療のメカニズムを用いた、遺伝病等に対する根治的な細胞治療製品の意。 |
※31 | 作用機序 | 薬剤がその薬理学的効果を発揮するための特異的な生化学的相互作用を意味する。 |
※32 | 遷延化 | 治癒までの期間が長期になること。 |
※33 | 動員因子 | 幹細胞を誘引・集積させるための物質。 |
※34 | セルプロセッシングセンター | 細胞の調整や、培養、加工などの工程(細胞プロセッシング Cell Processing )を行う場所。 |
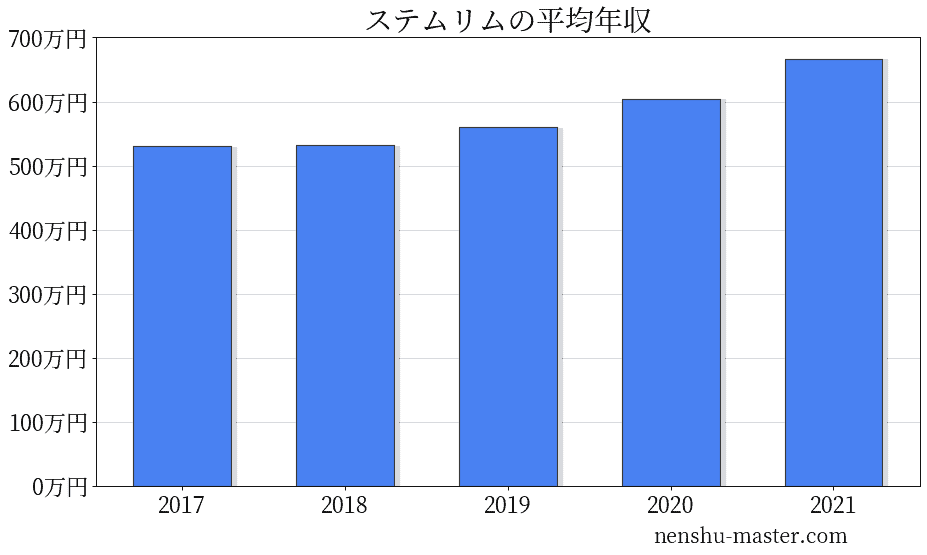
ステムリムの平均年収は667万円
生涯収入の全国平均である約1.9億円に対し、ステムリムの生涯収入はおよそ2.47億円と推定されます。
| 年 | 平均年収 |
|---|---|
| 2017 | 530万円 |
| 2018 | 532万円 |
| 2019 | 560万円 |
| 2020 | 604万円 |
| 2021 | 667万円 |
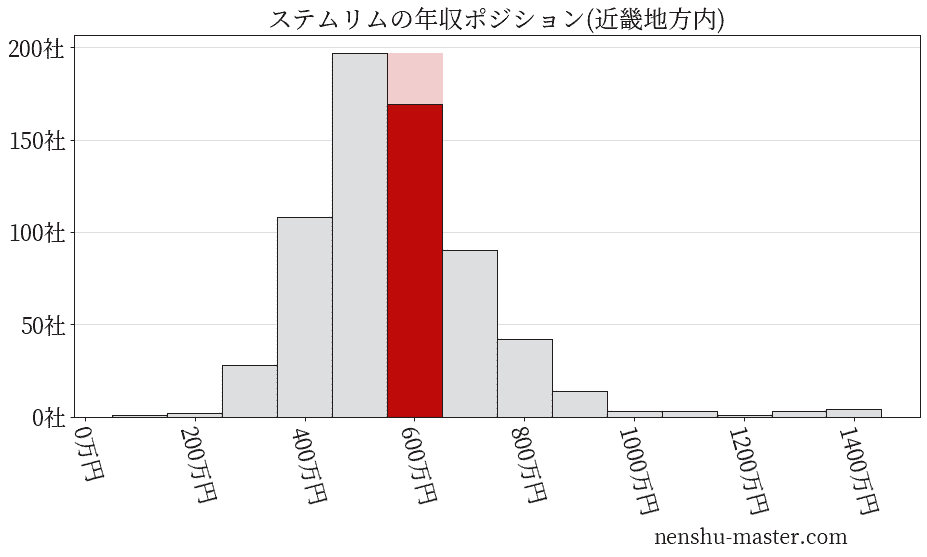
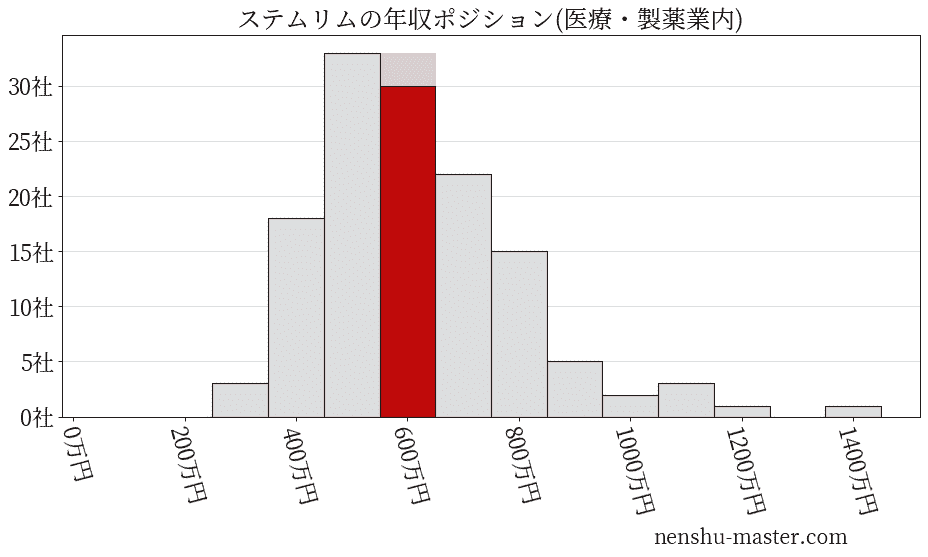
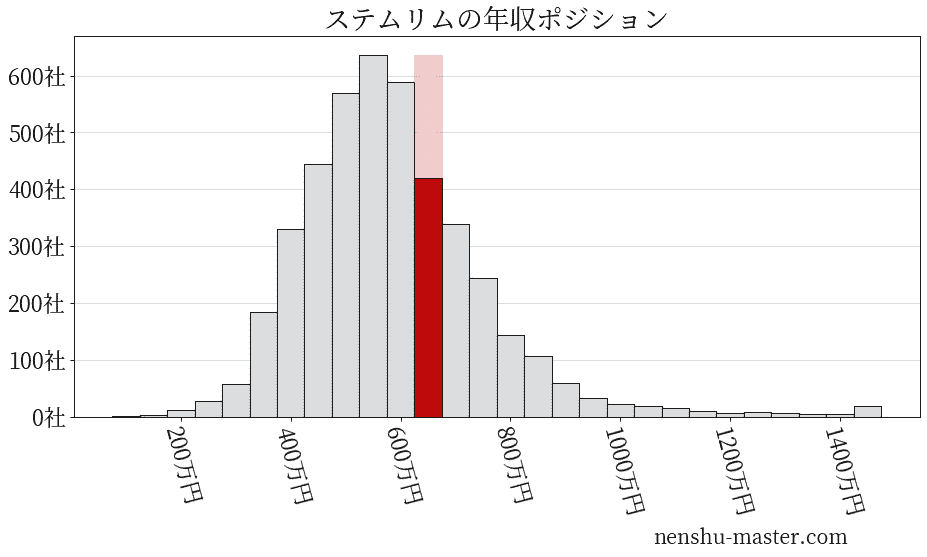
平均年収と社数のヒストグラム上ではステムリムは赤色の箇所に位置しています。 年収ランキングではステムリムは1576位(全4687社)で、年収偏差値は60.1でした。
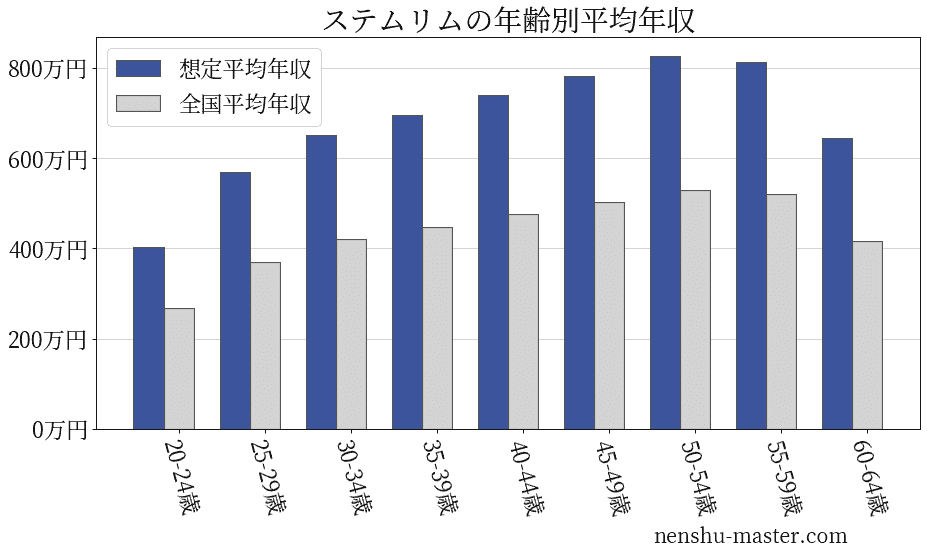
ステムリムの年齢別年収
| 年齢 | 想定平均年収 | 月額給与 |
|---|---|---|
| 20-24歳 | 403万円 | 31万円 |
| 25-29歳 | 570万円 | 44万円 |
| 30-34歳 | 651万円 | 50万円 |
| 35-39歳 | 696万円 | 54万円 |
| 40-44歳 | 742万円 | 57万円 |
| 45-49歳 | 784万円 | 60万円 |
| 50-54歳 | 827万円 | 64万円 |
| 55-59歳 | 813万円 | 63万円 |
| 60-64歳 | 644万円 | 50万円 |
ステムリムの賞与・ボーナス
| 年 | 平均賞与額 |
|---|---|
| 2017 | 71万円 |
| 2018 | 71万円 |
| 2019 | 75万円 |
| 2020 | 81万円 |
| 2021 | 89万円 |
ステムリムの業種・地域
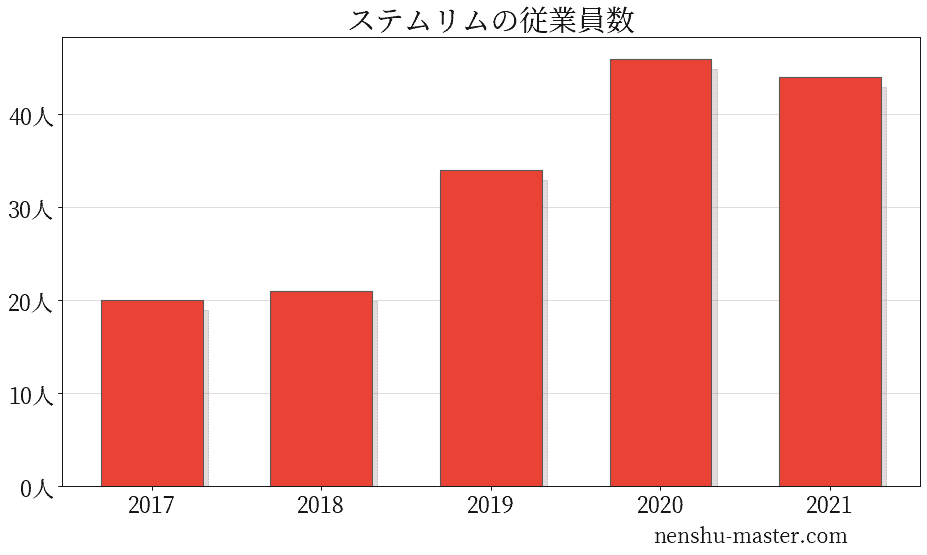
ステムリムの従業員数は44人
| 年 | 従業員数 |
|---|---|
| 2017 | 20人 |
| 2018 | 21人 |
| 2019 | 34人 |
| 2020 | 46人 |
| 2021 | 44人 |
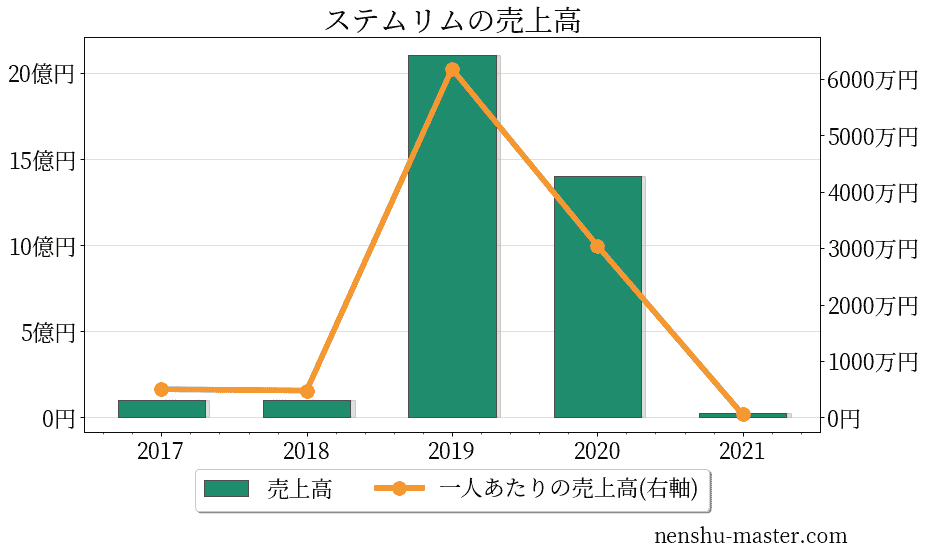
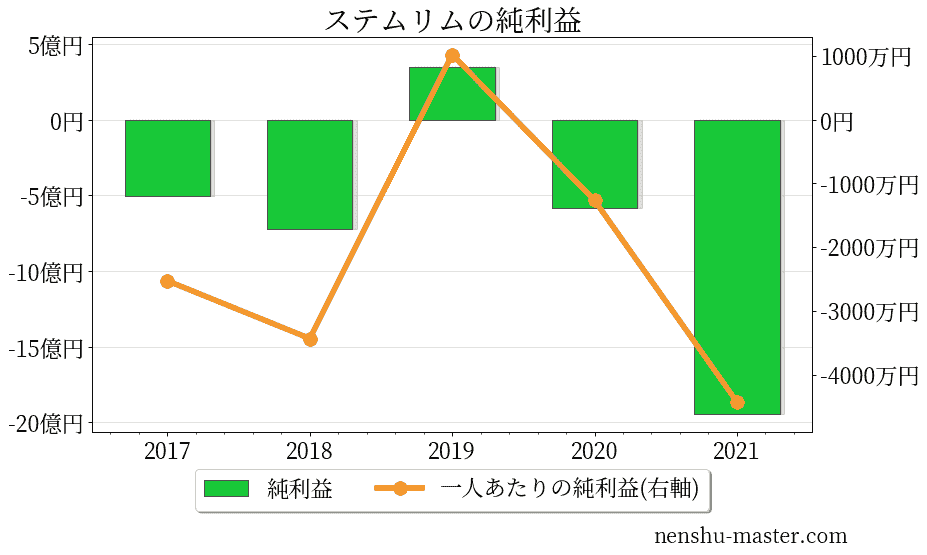
ステムリムの売上、純利益
【広告】ステムリムに転職するには?
転職サイトはサイトごとに特色があり、2〜3サイトを登録してそれぞれの良い部分を利用するのが賢い利用方法です。年収マスターイチオシのサイトを紹介します。
JACリクルートメント
「JACリクルートメント」はハイクラスな転職案件を多数持っており、市場価値の高い応募者におすすめのサイトです。 内資系の高額案件はもちろん、JACリクルートメントはイギリスやシンガポールでも展開しており、そのつながりを活かした外資系案件も多数あります。
他の転職サイトでは一気に大量の案件を提示されることがありどれを選べばわからないということが起こりますが、JACリクルートメントではそのようなことはありません。 ひとりの応募者につき複数のエージェントが担当し、選りすぐりの案件を紹介してくれるためマッチ度が高い仕事に出会えます。
ハイクラス案件をメインで扱うJACリクルートメントのみでしか得られない案件情報も多数あります。 上昇志向があり、現在のポジションからステップアップしてよりハイキャリアを目指す方にはイチオシのサイトです。
ランスタッド
「ランスタッド」は敏腕コンサルタントが専任で案件紹介をしてくれる転職サイトです。 ランスタッドのエージェントは評判が良く、最近人気が大きく伸びてきてきています。 よくある転職サイトはエージェントが十分なヒアリングも無くノルマ達成のためにたくさんの案件を紹介してきますが、 ランスタッドはそのようなことはありません。
ランスタッドは少数精鋭のコンサルタントで運営されており、現状のスキルや今後構築したいキャリアなどを入念にヒアリングした上で案件紹介をしてくれます。 特に20代後半から30代の転職に力を入れており、応募者にマッチした案件を紹介してくれます。
そのため案件の質も高く、JACリクルートメントと同様に高年収案件に強い印象です。800万円や1200万円を超える案件も多数あり、 ハイキャリアを目指す方には心強いパートナーです。ランスタッドのみでしか公開されてない案件もかなり多いので、 一度無料登録して相談してみることをオススメします。
参考書籍
ステムリムの歴史
| 2006年10月 | 国立大学法人大阪大学 大学院医学系研究科の玉井克人教授らが同定した骨髄多能性幹細胞動員因子を医薬品として開発することを目的に会社設立。 |
| 2007年4月 | 大阪大学との共同研究を開始。以後、研究成果の知財化を進め、これまでに107件の特許を取得。 |
| 2010年4月 | 本社を彩都バイオインキュベータに移転。彩都ラボ開設。塩野義製薬株式会社と骨髄由来幹細胞動員因子に関する共同研究契約締結。(注)1 |
| 2012年6月 | 神戸ポートアイランド内に神戸ラボを開設。疾患モデル動物を用いた薬効試験の実施体制を強化。 |
| 2013年7月 | 彩都バイオインキュベータ内のラボを増床。加えて自社の動物飼育/実験施設を開設し、神戸ラボの機能を吸収。 |
| 2014年4月 | 大阪大学最先端医療イノベーションセンターの共同研究プロジェクトに採択(テーマは「体内再生誘導医薬開発のための非臨床試験及び新規候補物質の探索」)。大阪大学ラボ開設。 |
| 2015年8月 | 大阪大学にてレダセムチドに関する医師主導治験開始。 |
| 2017年12月 | 大阪大学においてレダセムチドに関する表皮水疱症を対象とした医師主導治験(第Ⅱ相試験)開始。 |
| 2019年4月 | レダセムチドに関する脳梗塞を対象とした企業治験(第Ⅱ相試験)開始。 |
| 2019年8月 | 東京証券取引所マザーズに株式を上場。 |
| 2020年6月 | 大阪大学・テクノアライアンス棟に再生誘導医学協働研究所を開設。 |
| 2020年11月 | 国立大学法人弘前大学においてレダセムチドに関する変形性膝関節症を対象とした医師主導治験(第Ⅱ相試験)開始。 |
| 2020年11月 | 国立大学法人新潟大学においてレダセムチドに関する慢性肝疾患を対象とした医師主導治験(第Ⅱ相試験)開始。 |
| 2022年4月 | 東京証券取引所グロースに市場区分を変更。 |
| 2022年7月 | レダセムチドに関する栄養障害型表皮水疱症を対象とした追加第Ⅱ相臨床試験開始。 |
ステムリムの類似企業
| 企業名 | 平均年収 | 従業員数 |
|---|---|---|
| ブライトパス・バイオ | 869万円 | 32人 |
| セルソース | 651万円 | 109人 |
| ソレイジア・ファーマ | 1310万円 | 21人 |
| サンバイオ | 1190万円 | 37人 |
| セルシード | 573万円 | 30人 |
| メディネット | 538万円 | 96人 |
| ヘリオス | 799万円 | 70人 |
| タカラバイオ | 710万円 | 769人 |
| オンコリスバイオファーマ | 791万円 | 33人 |
| ジャパン・ティッシュ・エンジニアリング | 583万円 | 215人 |
ステムリムと平均年収が近い企業
| 企業名 | 平均年収 |
|---|---|
| メディカル一光グループ | 562万円 |
| ビオフェルミン製薬 | 575万円 |
| オンコセラピー・サイエンス | 580万円 |
| メディカルシステムネットワーク | 559万円 |
| ホギメディカル | 631万円 |
| 日医工 | 675万円 |
| カワチ薬品 | 545万円 |
| リニカル | 646万円 |
| ロート製薬 | 782万円 |
| カルナバイオサイエンス | 708万円 |
ステムリムと売上高が近い企業
| 企業名 | 売上高 |
|---|---|
| セラーテムテクノロジー | 1.01億円 |
| 多治見クラシック | 1.17億円 |
| リゾート&メディカル | 6058万円 |
| ゼネシス | 9896万円 |
| ストライダーズ | 9090万円 |
| 宮越HD | 9300万円 |
| 桃太郎源 | 5000万円 |
| メドレックス | 5948万円 |
| GNU | 5980万円 |
| 宮城県建設会館 | 9594万円 |