ブライトパス・バイオの平均年収
ブライトパス・バイオとは
| 企業名 | ブライトパス・バイオ |
|---|---|
| 本社所在地 | 川崎市川崎区殿町三丁目25番22号 |
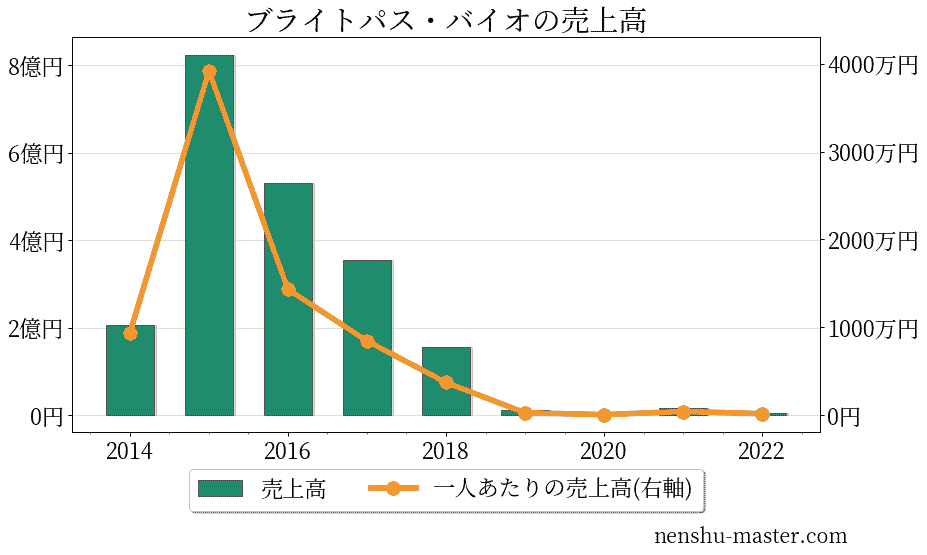
| 売上高 | 528万円 |
| 社員数 | 32人 |
| 平均年収 | 869万円 |
| 推定初任給 | 38万円 |
| 年収偏差値 | 70.8 |
| 平均年齢 | 47.4歳 |
| 平均勤続年数 | 3.8年 |
有価証券報告書によるとブライトパス・バイオの事業内容は次の通りです。
当社は、新規の「がん免疫治療薬」の開発に領域を定める、探索研究から早期臨床試験段階にある複数のパイプラインを有する創薬ベンチャーです。事業モデル、技術の特徴は以下のとおりであります。
(1) 事業モデル
当社の事業モデルは、新規がん免疫治療薬を自社創製もしくは導入し、探索研究から早期臨床試験までを手掛け、国内外の製薬会社に開発製造販売権をライセンスアウトし、ライセンス先からライセンス収入を得るものです。
医薬品開発は上市までに一般的に10年以上かかり、投資回収までが長く、開発後期段階になるほど要する資金が大きくなるため、ベンチャーで創薬を事業として成立させるためには、開発投資を早期に回収できる仕組みが必要ですが、医薬品産業においては大手製薬企業が開発途上にあるベンチャーが創製するシーズをライセンスインする取引が豊富に行われています。現在は承認薬に至ったシーズのうち、ベンチャーが創製するシーズの数が、従来の大手製薬企業のそれを上回るようになっています。
この事業モデルでは、上市前の開発段階で、ライセンス先製薬企業から開発進捗に応じたライセンス関連収入(ライセンス契約締結時の一時金、その後開発進捗に応じて設定したマイルストンを達成する毎に得られる開発マイルストン収入、上市後は製品売上高の一定割合を得る販売ロイヤリティ収入等)を得ることを目指します。ライセンス後もライセンス先企業と共同開発し、開発費の貢献に合わせて将来の利益を按分したり、ライセンス先から開発協力金を得て開発を主導する等、色々な形態があります。
当社は、様々な開発ステージにあるパイプライン(医薬品候補)の開発を同時並行で進めることにより、投資早期回収と黒字転換後の継続的な収入の実現を図ります。
(2) 開発中のがん免疫治療薬の特徴
がん免疫治療薬の開発では、動かなくなってしまったがん免疫を再び動くようにすること、いったん動いたがん免疫が、任務を終えた後に「元に戻る」仕組みによってブレーキをかけられるのを防ぎ、持続させることが、創薬のターゲットとなります。これに成功すればがんを治療できることは、2018年にノーベル賞を受賞したPD-1という免疫チェックポイント(免疫のブレーキ)を阻害する抗体が、がん治療に革新をもたらしたことによって、立証されてきました。今を生きる私たちは、この治療の革新の恩恵を受ける途上にあり、がんの個別性や免疫応答の多様性にどう対応していくか、未解明の領域がたくさん残されていると考えています。がん免疫にがんの目印を与えるがんワクチン、T細胞というがん免疫そのものを大量に外から投入する細胞医薬、PD-1以外にもいくつもある「免疫が元に戻る仕組み」を一定期間止める抗体医薬、これらが当社の開発している薬です。がんの克服を目指す人に、新たな治療選択肢を提供するために、これからも研究活動を推進してまいります。
(3) 開発パイプライン
当社の開発パイプラインは以下のとおりです。このほか、次世代パイプラインの構築を目的として複数の探索・非臨床試験研究を実施しております。
細胞医薬
〔iPS細胞由来再生NKT細胞療法:BP2201〕
BP2201(iPS-NKT)は、iPS細胞から分化誘導したナチュラル・キラーT(NKT)細胞*1をがん治療に用いる新規の他家細胞医薬です。NKT細胞は、がん細胞を直接殺傷する能力をもつと同時に、他の免疫細胞を活性化することにより、間接的にも抗腫瘍効果を発揮する免疫細胞です。しかし、ヒト末梢血中にわずか0.01~0.1%程度しか存在しないとされ、NKT細胞を体外に取り出し、がん治療に必要な細胞数まで培養・増殖させることが非常に難しいという課題がありました。
そこで国立研究開発法人理化学研究所(以下「理研」)では、生命医科学研究センター副センター長の古関明彦氏を中心に、この課題を解決する方法として、iPS細胞技術を用いることが計画されました。具体的には、NKT細胞を初期化して樹立したiPS細胞(NKT-iPS細胞)から再度NKT細胞(iPS-NKT細胞)に分化・誘導可能なことが示され、2010年、iPS細胞から抗腫瘍活性を備えたNKT細胞だけを大量に作り出すことに成功しました。
当社は、本細胞療法の研究開発に、開発元の理研とともに取り組んでまいりましたが、2022年11月に導入オプション権を行使し、全世界で独占的に開発・製造・販売するライセンスを取得しました。
本ライセンスにより、1)iPS由来NKT細胞の他家細胞療法使用を広範かつ排他的に保護する「特許」(日米欧で登録済み)、2)現在進行中の治験によって臨床上の安全性と一定の有効性の示唆が期待される「マスターiPSセルバンク」、3)マスターiPSセルバンクからNKT細胞へ高純度で大量に分化誘導させる「製造法」の3つで構成されるプラットフォームを有することになりました。
このプラットフォームは、いろいろながん種のがん抗原に対するCAR遺伝子を導入した、新たな遺伝子改変iPS-NKT細胞医薬へ展開する土台となり、幅広いがん種と世界の幅広い地域への展開を可能にします。
また、2020年6月より国立大学法人千葉大学において頭頸部がんを対象とするiPS-NKTの臨床第Ⅰ相医師主導治験(以下「本治験」)が行われています。
〔HER2 CAR-T細胞療法:BP2301〕
BP2301は、様々な固形がんで高発現するHER2を標的抗原とするCAR-T細胞療法*2です。CAR-T細胞療法とは、がん細胞が細胞表面上に発現する抗原(がんの目印)を認識するキメラ抗原受容体(CAR: Chimeric Antigen Receptor)を、体外でT細胞に遺伝子導入し、CARを導入したCAR-T細胞を培養で増殖させて投与する治療法です。
これまで血液がんを標的とするCAR-T細胞療法は、優れた臨床効果が臨床試験で示され、グローバルで承認されてきました。しかし、より多くの方が罹患される固形がんへの展開においては、投与されたCAR-T細胞が、免疫抑制的な腫瘍微小環境において疲弊して機能を喪失し、十分に臨床効果を発揮できないという課題が明らかになってきました。
この課題を解決するために、BP2301 では、体内での優れた複製能と長期生存能を特徴とし、それによって腫瘍微小環境における疲弊抵抗性と持続的抗腫瘍効果が期待される幹細胞様免疫記憶型(ステムセル・メモリー・フェノタイプ)細胞を多く含むCAR-T細胞を用います。これは、信州大学の中沢洋三教授の非ウイルス遺伝子導入法に基づき、中沢教授及び同大学柳生茂希教授と新規の細胞培養法を共同開発したことによって可能になりました。
2022年5月より国立大学法人信州大学においてHER2陽性の再発・進行骨・軟部肉腫及び婦人科悪性腫瘍を対象とする遺伝子改変HER2 CAR-T細胞の臨床第Ⅰ相医師主導治験が行われています。
抗体医薬
抗体医薬では、腫瘍組織においてがん細胞を排除する免疫の働きを抑制する免疫チェックポイント分子*3もしくは免疫調整分子に結合し、その機能を阻害する抗体の開発を進めています。がん免疫を抑制するアデノシン産生に介入するCD73とCD39をそれぞれ標的とするBP1200とBP1202、免疫細胞に発現し、その抑制に関わるTIM-3を標的とするBP1210のほかに、CD39とTIM-3を共発現する免疫細胞において同時に阻害する抗CD39×抗TIM-3二重特異性抗体BP1212を開発パイプラインとして有します。
がんワクチン
〔免疫チェックポイント抗体連結個別化ネオアンチゲン・ワクチン:BP1209〕
BP1209は、がん細胞由来の遺伝子変異に由来しヒトの免疫システムが高い反応性を示すネオアンチゲンを標的とするがん免疫を、患者1人ひとりに対応して誘導するのに最適化された、完全個別化ネオアンチゲン・ワクチン*4・プラットフォームです。ワクチンとなるネオアンチゲン・ペプチドを、T細胞へ標的情報を伝える樹状細胞へ送達するのに免疫チェックポイント抗体を用います。同抗体への結合が可能となるよう当社オリジナルのリンカー技術が組み込まれています。抗腫瘍免疫を指令する樹状細胞に効率よくワクチン抗原を送達することによって、ネオアンチゲンを標的とするT細胞をペプチド単体よりもはるかに強力に惹起させることを、担がんマウスモデルで証明しました。
今後、個別化ネオアンチゲン・ワクチン開発は、BP1209のフォーマットに絞って、臨床応用に向けて準備を進めていきます。
〔がんペプチドワクチンGRN-1201〕
GRN-1201は、欧米人に多いHLA*5-A2型の共通抗原ペプチド4種で構成される、米国や欧州を始めとするグローバル展開を想定したがんペプチドワクチンです。2022年5月に米国で実施してきたGRN-1201の非小細胞肺がんを対象とする免疫チェックポイント抗PD-1抗体併用第Ⅱ相臨床試験の早期中止を決定し、現在は当初の治験対象と試験プロトコルを見直し、開発パートナーと新しく臨床試験を開始する道を模索しています。
(4) 許認可、免許及び登録等の状況について
① 許認可、免許及び登録、行政指導等
医薬品開発は、各国の医薬品の開発及び当局への申請等に関する法律、日本では「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(略称:薬機法、2014年11月25日施行、「薬事法」から改称)、米国では「連邦食品・医薬品・化粧品法(Federal Food, Drug, and Cosmetic Act)及びその関連する法令」、上記の他、日本及び米国を含め各国における当局の省令やガイダンス、ならびに安全性に関する非臨床試験の実施基準(GLP;Good Laboratory Practice)、臨床試験の実施基準(GCP;Good Clinical Practice)、製造管理及び品質管理規則(GMP;Good Manufacturing Practice)の下で進めております。
② 知的財産権の状況
当社は、2022年11月に理研からiPS由来NKT細胞を全世界で独占的に開発・製造・販売する権利を導入するオプション権を行使し、iPS由来NKT細胞の他家細胞療法使用を広範かつ排他的に保護する特許の独占実施権を得ました。
<主要な特許の状況>
発明の名称 | 特許登録番号 | 出願国 | 権利者 |
上皮細胞増殖因子受容体(EGFR)由来ペプチド | 4579836 | 日本 | 当社 |
7655751 | 米国 | ||
副甲状腺ホルモン関連タンパク質のHLA-A24またはHLA-A2結合ペプチド | 4579581 | 日本 | 当社 |
がんペプチドワクチン | 5706895 | 日本 | 当社 |
5980303 | 日本 | ||
NKT細胞由来iPS細胞およびそれ由来のNKT細胞 | 5652783 | 日本 | 理研 |
8945922 | 米国 | ||
2336303 | 欧州 | ||
アロNKT細胞を用いた免疫療法およびそのためのT細胞抗原受容体(TCR)遺伝子のα鎖領域が均一なVα-Jαに再構成されている細胞および該細胞由来NKT細胞のバンキング | 6320473 | 日本 | 理研 |
10813950 | 米国 | ||
264738 | 欧州 |
(注)欧州については、欧州特許条約に則った特許出願(EPC出願)によっております。
[用語解説]
*1(NKT細胞)
ナチュラル・キラー(NK)細胞とT細胞の特徴を併せもち、自然免疫と獲得免疫をつなぐ役割をもつ免疫細胞。がん細胞をT細胞受容体やNK細胞受容体を通して直接殺傷する能力をもつと同時に、T細胞や樹状細胞など他の免疫細胞を活性化させるアジュバント作用をもつ。活性化すると、多様なサイトカインを産生し、自然免疫系に属するNK細胞の活性化と樹状細胞の成熟化を促す。成熟した樹状細胞は、さらに獲得免疫系に属するキラーT細胞を増殖・活性化させることで、相乗的に抗腫瘍効果が高まる。
*2(CAR-T細胞療法)
Chimeric Antigen Receptor T-cell Therapy:キメラ抗原受容体遺伝子導入T細胞療法。がん細胞が発現する抗原を認識するキメラ抗原受容体を、T細胞(抗腫瘍免疫をもつリンパ球の一種)に遺伝子導入し、培養で増殖させて投与する治療法。
*3(免疫チェックポイント分子)
免疫恒常性を保つために自己に対する免疫応答を抑制するとともに、過剰な免疫反応を抑制する分子群のこと。がん免疫においては、過剰な活性化によって自己を攻撃するのを防ぐために存在しているが、発がん過程では、がん細胞が免疫系からの攻撃を回避し増殖するために利用される。
*4(完全個別化ネオアンチゲン・ワクチン)
個々の患者のがん細胞にあるネオアンチゲンを探索し、これに対するオーダーメイドのがんワクチン。海外ではアカデミアや先行開発企業による臨床試験が行われており、その中にはネオアンチゲンをコードするmRNAを脂質ナノパーティクル(LNP)に格納したmRNAワクチンも含まれる。
*5(HLA)
Human Leukocyte Antigen=ヒト白血球抗原は、体のほとんど全ての細胞表面で発現がみられる、免疫機構において重要なタンパク質で、細菌やウイルスなどの病原体の排除やがん細胞の拒絶、臓器移植の際の拒絶反応などに関与しており「主要組織適合遺伝子複合体」とも呼ばれている。HLAはがん細胞でも細胞表面上に発現しており、がんワクチンの作用機序においては、がん細胞内でがん抗原タンパクが分解されて生成されたペプチドと結合して細胞表面に移動し、CTLにがん細胞として認識させるように機能する。HLAは自己と非自己(他)を区別する「自他認識のマーカー」であり、非常に多様な「他(た)」を自己と区別するために、非常に多様な型がある。ペプチドはHLAの特定の型に結合し、型が合わない場合は結合しない。
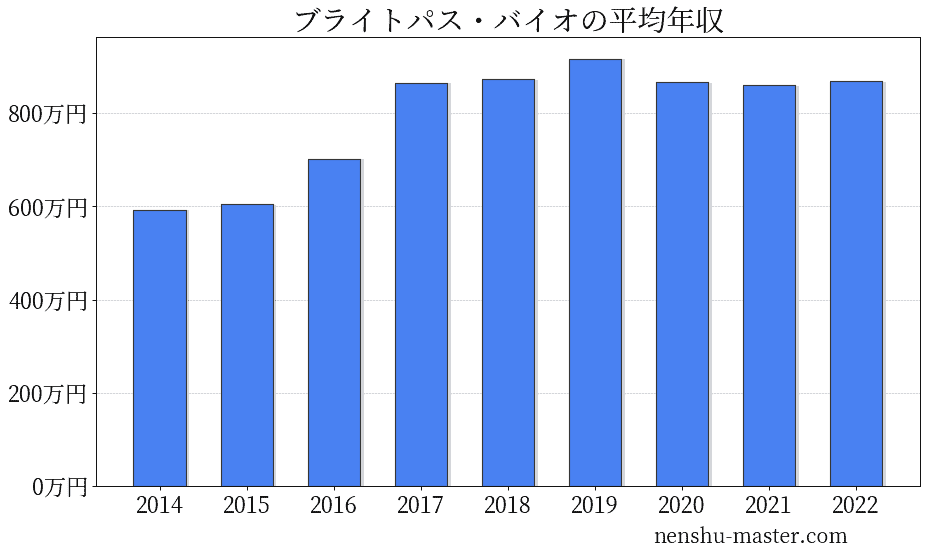
ブライトパス・バイオの平均年収は869万円
生涯収入の全国平均である約1.9億円に対し、ブライトパス・バイオの生涯収入はおよそ3.22億円と推定されます。
| 年 | 平均年収 |
|---|---|
| 2014 | 593万円 |
| 2015 | 605万円 |
| 2016 | 702万円 |
| 2017 | 865万円 |
| 2018 | 873万円 |
| 2019 | 917万円 |
| 2020 | 866万円 |
| 2021 | 860万円 |
| 2022 | 869万円 |
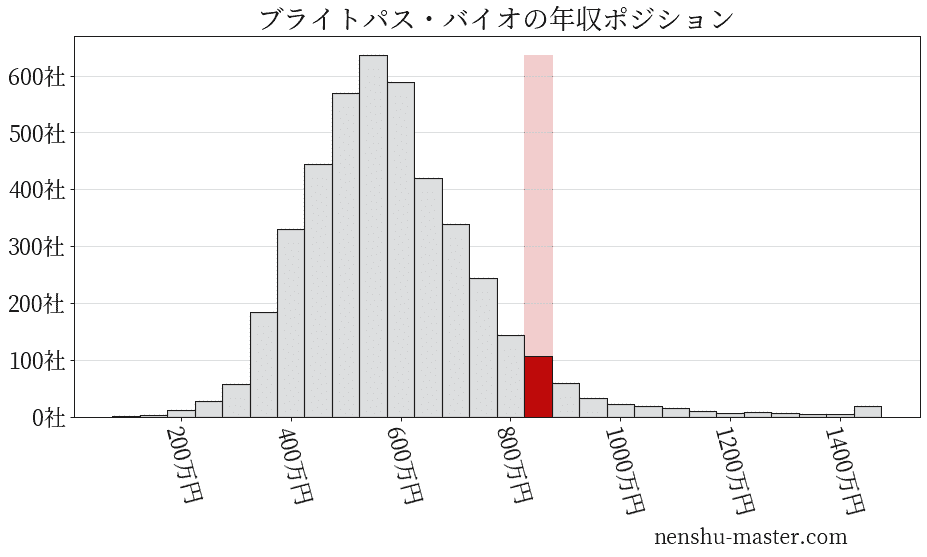
平均年収と社数のヒストグラム上ではブライトパス・バイオは赤色の箇所に位置しています。 年収ランキングではブライトパス・バイオは355位(全4687社)で、年収偏差値は70.8でした。
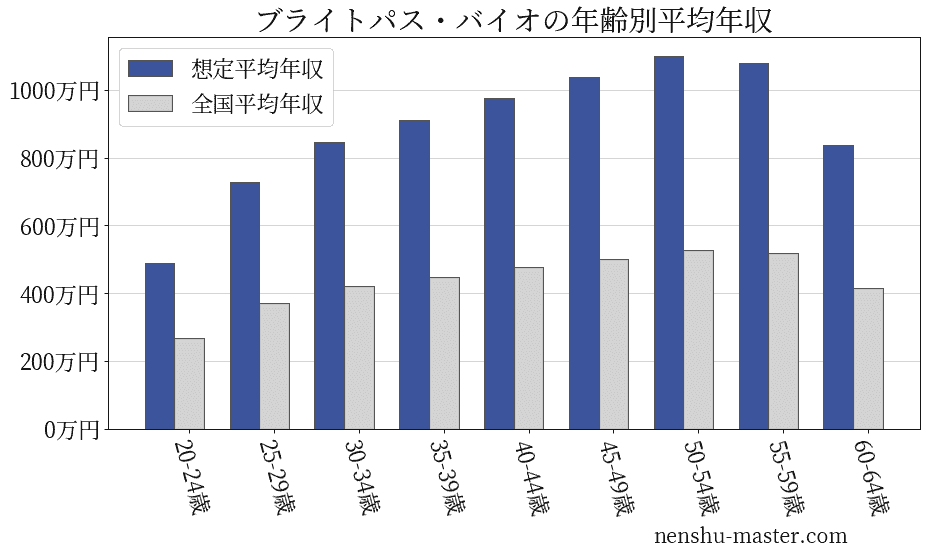
ブライトパス・バイオの年齢別年収
| 年齢 | 想定平均年収 | 月額給与 |
|---|---|---|
| 20-24歳 | 488万円 | 38万円 |
| 25-29歳 | 729万円 | 56万円 |
| 30-34歳 | 846万円 | 65万円 |
| 35-39歳 | 911万円 | 70万円 |
| 40-44歳 | 977万円 | 75万円 |
| 45-49歳 | 1037万円 | 80万円 |
| 50-54歳 | 1100万円 | 85万円 |
| 55-59歳 | 1079万円 | 83万円 |
| 60-64歳 | 836万円 | 64万円 |
ブライトパス・バイオの賞与・ボーナス
| 年 | 平均賞与額 |
|---|---|
| 2014 | 79万円 |
| 2015 | 81万円 |
| 2016 | 94万円 |
| 2017 | 115万円 |
| 2018 | 116万円 |
| 2019 | 122万円 |
| 2020 | 115万円 |
| 2021 | 115万円 |
| 2022 | 116万円 |
ブライトパス・バイオの業種・地域
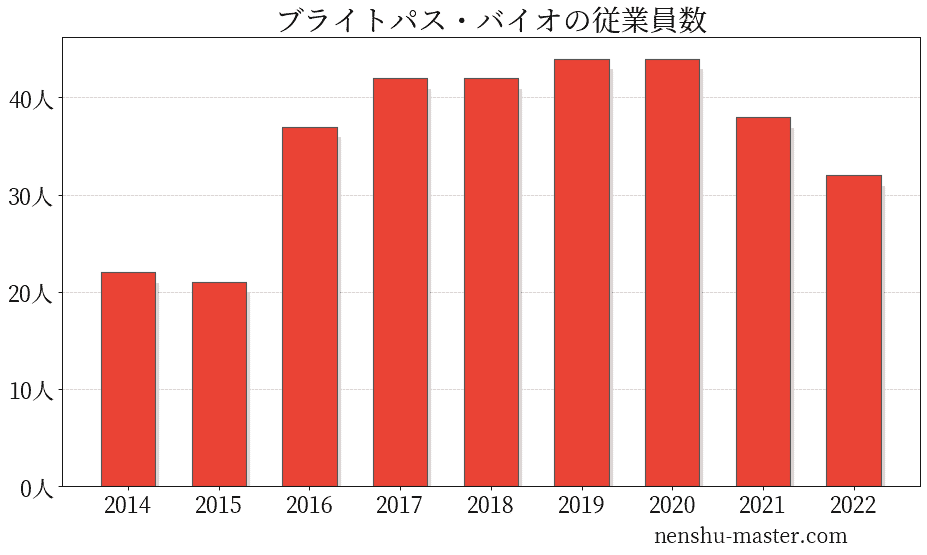
ブライトパス・バイオの従業員数は32人
| 年 | 従業員数 |
|---|---|
| 2014 | 22人 |
| 2015 | 21人 |
| 2016 | 37人 |
| 2017 | 42人 |
| 2018 | 42人 |
| 2019 | 44人 |
| 2020 | 44人 |
| 2021 | 38人 |
| 2022 | 32人 |
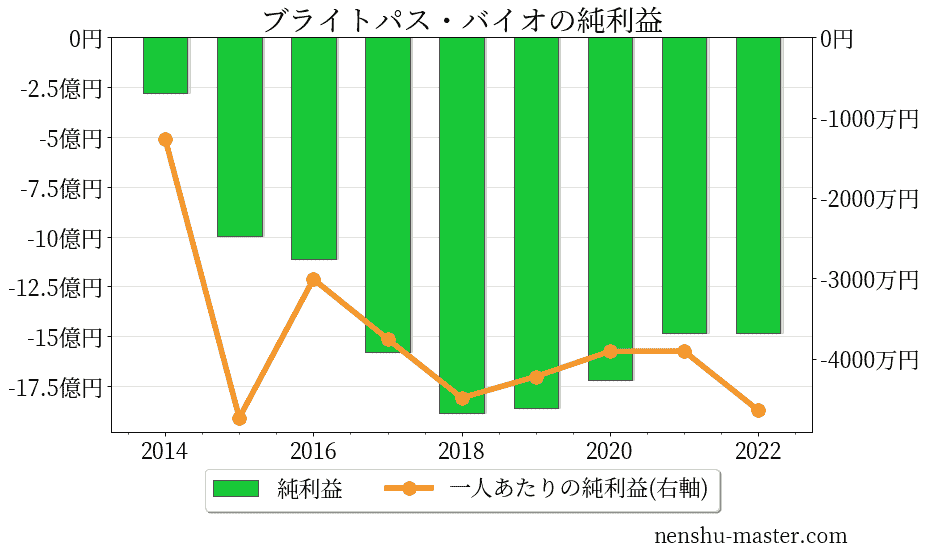
ブライトパス・バイオの売上、純利益
【広告】ブライトパス・バイオに転職するには?
転職サイトはサイトごとに特色があり、2〜3サイトを登録してそれぞれの良い部分を利用するのが賢い利用方法です。年収マスターイチオシのサイトを紹介します。
JACリクルートメント
「JACリクルートメント」はハイクラスな転職案件を多数持っており、市場価値の高い応募者におすすめのサイトです。 内資系の高額案件はもちろん、JACリクルートメントはイギリスやシンガポールでも展開しており、そのつながりを活かした外資系案件も多数あります。
他の転職サイトでは一気に大量の案件を提示されることがありどれを選べばわからないということが起こりますが、JACリクルートメントではそのようなことはありません。 ひとりの応募者につき複数のエージェントが担当し、選りすぐりの案件を紹介してくれるためマッチ度が高い仕事に出会えます。
ハイクラス案件をメインで扱うJACリクルートメントのみでしか得られない案件情報も多数あります。 上昇志向があり、現在のポジションからステップアップしてよりハイキャリアを目指す方にはイチオシのサイトです。
ランスタッド
「ランスタッド」は敏腕コンサルタントが専任で案件紹介をしてくれる転職サイトです。 ランスタッドのエージェントは評判が良く、最近人気が大きく伸びてきてきています。 よくある転職サイトはエージェントが十分なヒアリングも無くノルマ達成のためにたくさんの案件を紹介してきますが、 ランスタッドはそのようなことはありません。
ランスタッドは少数精鋭のコンサルタントで運営されており、現状のスキルや今後構築したいキャリアなどを入念にヒアリングした上で案件紹介をしてくれます。 特に20代後半から30代の転職に力を入れており、応募者にマッチした案件を紹介してくれます。
そのため案件の質も高く、JACリクルートメントと同様に高年収案件に強い印象です。800万円や1200万円を超える案件も多数あり、 ハイキャリアを目指す方には心強いパートナーです。ランスタッドのみでしか公開されてない案件もかなり多いので、 一度無料登録して相談してみることをオススメします。
参考書籍
ブライトパス・バイオの歴史
| 2003年5月 | 福岡県久留米市旭町67番地に当社設立 |
| 2006年1月 | ITK-1の去勢抵抗性前立腺がんに対する第Ⅰ相臨床試験を開始 |
| 2009年6月 | 東京支社を東京都文京区本郷に設置 |
| 2013年6月 | ITK-1の去勢抵抗性前立腺がん患者に対する第Ⅲ相臨床試験を開始 |
| 2015年10月 | GRN-1201のメラノーマ患者に対する第Ⅰ相臨床試験を開始 |
| 2017年1月 | GRN-1201の免疫チェックポイント阻害剤との併用による非小細胞肺がんに対する米国での第Ⅱ相臨床試験を開始 |
| 2020年6月 | iPS-NKT細胞療法の医師主導治験開始 |
| 2022年4月 | 東京証券取引所の市場区分の見直しによりマザーズ市場からグロース市場へ移行 |
| 2022年5月 | HER2 CAR-T細胞療法の医師主導治験開始 |
ブライトパス・バイオの類似企業
| 企業名 | 平均年収 | 従業員数 |
|---|---|---|
| ステムリム | 667万円 | 44人 |
| テラ | 535万円 | 20人 |
| メディネット | 538万円 | 96人 |
| オンコセラピー・サイエンス | 580万円 | 28人 |
| オンコリスバイオファーマ | 791万円 | 33人 |
| タカラバイオ | 710万円 | 769人 |
| カイオム・バイオサイエンス | 727万円 | 49人 |
| DeltaーFly Pharma | 663万円 | 11人 |
| ソレイジア・ファーマ | 1310万円 | 21人 |
| ヘリオス | 799万円 | 70人 |
ブライトパス・バイオと平均年収が近い企業
ブライトパス・バイオと売上高が近い企業
| 企業名 | 売上高 |
|---|---|
| ジパング | 457万円 |
| アンジェス | 6706万円 |
| 21LADY | 2070万円 |
| リゾート&メディカル | 6058万円 |
| AvanStrate | 5707万円 |
| 燦キャピタルマネージメント | 1603万円 |
| エル・シー・エーHD | 3806万円 |
| 千葉県建設業センター | 5941万円 |
| ファンペップ | 107万円 |
| LTTバイオファーマ | 1527万円 |


