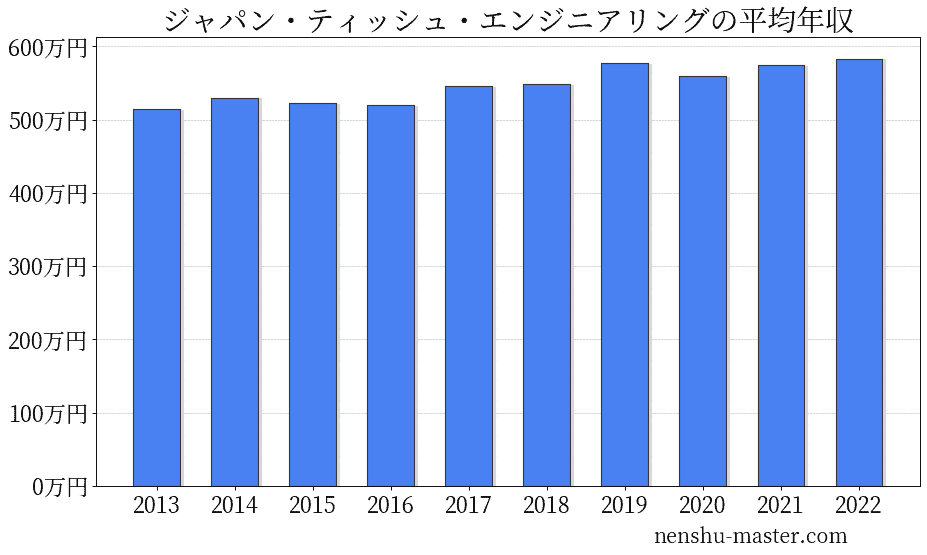
ジャパン・ティッシュ・エンジニアリングの平均年収
ジャパン・ティッシュ・エンジニアリングとは
| 企業名 | ジャパン・ティッシュ・エンジニアリング |
|---|---|
| 本社所在地 | 蒲郡市三谷北通6丁目209番地の1 |
| 売上高 | 20.3億円 |
| 社員数 | 215人 |
| 平均年収 | 583万円 |
| 推定初任給 | 27万円 |
| 年収偏差値 | 55.7 |
| 平均年齢 | 38.0歳 |
| 平均勤続年数 | 9.4年 |
有価証券報告書によるとジャパン・ティッシュ・エンジニアリングの事業内容は次の通りです。
当社は、「医療の質的変化をもたらすティッシュエンジニアリングをベースに、組織再生による根本治療を目指し、21世紀の医療そのものを変えてゆく事業を展開する」ことを会社設立の趣旨とする企業です。「再生医療をあたりまえの医療に」をビジョンに掲げ、再生医療等製品の開発、製造、販売を行う再生医療製品事業、再生医療に関する開発及び製造等を受託する再生医療受託事業、研究用ヒト培養組織の開発、製造、販売を行う研究開発支援事業を展開しております。
当社は、2021年3月9日付で帝人グループとなりました。親会社である帝人株式会社との協創により事業を拡大してまいります。
[事業の系統図]
(1)当社事業の根幹となる技術
近年、細胞培養や生体材料工学等の技術進歩により、生物から採取した細胞を用いて、性質の改変、体外での培養、組織・臓器の再形成、新たな機能の付加あるいは機能の修復等が試みられるようになりました。このような要素技術を利用して組織の再生を実現するための技術がティッシュエンジニアリングと呼ばれるものであり、当社事業の根幹となる技術です。
ティッシュエンジニアリングを実現するためには、生きた細胞、人工的に作られた材料・素材、細胞や生体に影響をもたらす種々の生理活性物質が必要であり、医学・工学・理学・薬学等の異分野間の国際的な研究交流が必要とされます。我が国では、ティッシュエンジニアリングにより作り出された組織や臓器を製品として医療目的で製造・販売するためには、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(医薬品医療機器等法)のもとで、厚生労働省からの許認可が必要になります。この許認可には、製造管理及び品質管理に関する基準が含まれており、当社が保有している製造施設・設備、創業以来の研究開発活動で培ってきた製造方法、品質管理に関するノウハウ、そして販売に関する組織体制やノウハウも、当社事業の根幹となる技術であるといえます。
また、細胞培養に用いる細胞は、その由来に応じて、自家細胞(本人)、同種細胞(本人以外)、異種細胞(ヒト以外の動物)に分類されますが、自家移植は、一般的に免疫拒絶反応が少なく、生体への生着能が高いといわれております。
当社は、当該技術を活用することにより、ヒトの細胞を培養して組織や臓器を作り出し、これを医療用途及び研究用途に提供することを目的として事業を展開しております。
(2)再生医療製品事業
再生医療とは、従来の薬物治療とは異なり、われわれの身体に備わっている組織の再生能力を引き出すことにより、失われた組織や臓器の機能を細胞を使って回復させることに主眼をおいた医療です。当社は、ティッシュエンジニアリングを利用した再生医療等製品を開発し、当該製品を医療機関向けに医療目的で製造販売しております。
①当社の再生医療等製品
現在、日本において再生医療等製品は19製品が承認されており、当社の自家培養表皮ジェイスは国内第1号として製造販売承認を取得しました。自家培養軟骨ジャックと自家培養角膜上皮ネピックは、それぞれ整形外科領域と眼科領域における国内初の再生医療等製品として製造販売承認を取得しました。自家培養口腔粘膜上皮オキュラルは、眼科領域における国内2つ目の再生医療等製品として製造販売承認を取得しました。また、当社5つ目の再生医療等製品として、2023年3月にメラノサイト含有自家培養表皮ジャスミンの製造販売承認を取得しました。
(a)自家培養表皮ジェイス
1975年、米国マサチューセッツ工科大学のHoward Green教授(2015年没、米国ハーバード大学医学部 名誉教授)らは、ヒトの正常な表皮細胞の培養方法を確立し、皮膚(表皮)に類似した細胞シートを開発しました。1984年には、重症熱傷を負った米国の2人の小児に対して、わずかに焼け残った自身の皮膚から培養表皮シートを作製・移植した報告が、大きな注目を集めました。
自家培養表皮ジェイスは、この技術を使用しており、当社は、開発者であるHoward Green教授から技術指導を受け、培養表皮シートの開発を進めてきました。本品は、患者自身の皮膚組織を少量取り、約3週間の培養期間を経て、患者本人に移植する自家培養表皮シートです。
本品は、2007年10月に重症熱傷治療を目的とした製品として製造販売承認を取得、2009年1月より保険適用を受け、我が国で第1号となる再生医療等製品となりました。本品は、適応拡大として2016年9月には先天性巨大色素性母斑の治療を目的とした製品として一部変更承認を受け、2016年12月より保険適用を受けました。さらに2018年12月には表皮水疱症の治療を目的とした製品として一部変更承認を受け、2019年7月より保険適用を受けました。
(b)自家培養軟骨ジャック
膝や肘の関節軟骨は、血管がないために、ケガ等で一度損傷を受けると自然には治りません。また、これらを薬等で治療することは非常に困難です。広島大学大学院整形外科の越智光夫教授(現、広島大学長)は、アテロコラーゲンというゲル状の物質の中で軟骨細胞を3次元培養する軟骨損傷治療用の移植組織を開発しました。従来、軟骨細胞懸濁液の移植治療が知られていましたが、越智教授が開発された移植組織は軟骨細胞が本来有する性質を維持しており、細胞が漏出しない点において優位性を持っております。
自家培養軟骨ジャックは、この技術を使用しており、開発者である越智教授から技術指導を受け、培養軟骨組織の開発を進めてきました。本品は、軟骨損傷患者の関節(非荷重部)から少量採取した軟骨細胞をアテロコラーゲンゲルの中で約4週間培養し、患者本人の軟骨欠損部に移植する自家培養軟骨組織です。
本品は、2012年7月に膝関節における外傷性軟骨欠損症又は離断性骨軟骨炎(変形性膝関節症を除く)の臨床症状の緩和を目的とした製品として製造販売承認を取得、2013年4月より保険適用を受け、整形外科領域で国内初の再生医療等製品となりました。2019年1月には自家培養軟骨ジャック移植時に患者自身の骨膜に代わって人工のコラーゲン膜を使用する一部変更申請承認を受けました。これにより患者の身体的負担軽減と医師の手技の簡便化を図ることができます。
当社は、2018年7月に外傷等に起因する二次性の変形性膝関節症を対象とする適応拡大のための治験計画届書を提出しました。治験は計画通り進んでおり、速やかにデータをまとめて申請準備を行います。
(c)自家培養角膜上皮ネピック
1997年、Pellegrini教授(現、イタリアModena and Reggio Emilia大学教授)らは、角膜と結膜の境界である角膜輪部組織から分離した角膜上皮細胞をフィブリンゲル製剤を足場として培養・作製した自家培養角膜上皮を角膜上皮幹細胞疲弊症の患者本人に世界で初めて移植し、良好な結果を報告しました。角膜輪部組織には角膜上皮幹細胞が存在し、角膜上皮細胞を供給するとともに結膜上皮細胞の侵入を阻み、角膜上皮の透明性を維持する重要な役割を担っております。
自家培養角膜上皮ネピックは、この技術を使用しており、患者自身の角膜輪部組織から角膜上皮幹細胞を採取してシート状に培養したもので、本品を移植することにより角膜上皮を再建させることを目的としております。当社は株式会社ニデックから本品の製品開発を受託し、開発者であるG. Pellegriniの技術指導のもと、自家培養角膜上皮の開発を進めてきました。
本品は、2020年3月に角膜上皮幹細胞疲弊症の治療を目的とした製品として製造販売承認を取得、2020年6月より保険適用を受け、眼科領域で国内初の再生医療等製品となりました。
(d)自家培養口腔粘膜上皮オキュラル
本品の開発において、大阪大学大学院医学系研究科(脳神経感覚器外科学(眼科学))の西田幸二教授、大家義則講師らにより、国立研究開発法人日本医療研究開発機構(AMED)からの支援を受けて、角膜上皮幹細胞疲弊症を対象とした医師主導治験が実施されました。当社は、西田幸二教授が世界に先駆けて開発した自家培養口腔粘膜上皮細胞シート移植の技術を導入するとともに、当該医師主導治験を引き継ぎ、開発を行ってきました。
自家培養口腔粘膜上皮オキュラルは、患者自身の口腔粘膜組織を採取し、分離した細胞を培養して作製するヒト(自己)口腔粘膜由来上皮細胞シートです。患者の眼表面に本品を移植することにより、患者自身の口腔粘膜上皮細胞が生着・上皮化し、欠損した角膜上皮を修復することを目的としております。
本品は、2021年6月に角膜上皮幹細胞疲弊症の治療を目的とした再生医療等製品として製造販売承認を取得、2021年12月より保険適用を受け、眼科領域で2つ目の再生医療等製品となりました。角膜上皮幹細胞疲弊症によって両眼の角膜が広範囲に障害を受け、視力が著しく低下した患者に対する新たな治療法として期待されております。
(e)メラノサイト含有自家培養表皮ジャスミン
メラノサイト含有自家培養表皮ジャスミンは、患者自身の皮膚組織を採取し、分離した細胞をメラノサイトが保持されるように培養した、患者自身に使用する表皮細胞シートです。非外科的治療が無効又は適応とならない白斑の患部に対して、表皮層を薄く削った後に移植します。本品の移植によりメラノサイトが供給され、色素を再生することを目的としています。ジャスミンは既存の外科的治療に比べ、少ない面積の皮膚組織を用いて製造するため患者への侵襲が少なく、かつ一度に広範囲の治療を行うことが可能となります。また、本治療法で色素再生することにより、患者の整容面での心理的重圧の軽減と生活の質(QOL)の向上も期待されます。
本品は、2023年3月に白斑の治療を目的とした再生医療等製品として製造販売承認を取得しました。今後、速やかに保険適用を目指します。
[当社の再生医療等製品一覧]
*1 医薬品医療機器等法による製造販売承認では、適応対象が明確に決められており、それ以外の疾患の治療には、当該製品を使用することはできません。そこで、使用できる疾患の範囲を拡大するためには、拡大の対象となる疾患につき、承認取得後に適応対象を拡大するための追加治験を実施し、その有効性を確認したうえで治療の対象となる疾患を追加するための一部変更承認申請を行うことが医薬品医療機器等法上必要とされております。このように、再生医療等製品につき、治療対象となる疾患の種類を増やすことを「適応拡大」といいます。
*2 適応対象は、当社が想定しているものです。
②自家細胞を用いた再生医療等製品のビジネスモデル
当社は培養技術を利用した再生医療等製品を開発し、医療機関向けに医療目的で製造販売しております。当社の再生医療等製品は、現在、患者本人の細胞を培養し、患者本人に移植する「自家移植」を対象としております。
当社は、長年にわたって自家移植を対象とした再生医療等製品を製造販売してきたことにより、自家の再生医療等製品に関する製造管理や品質管理に関するノウハウに加え、製品開発や販売に関する組織体制やノウハウを蓄積してきました。このようなノウハウは、当社の今後の事業に大きく役立たせることができます。
(3)再生医療受託事業
当社は、医薬品医療機器等法のもと、再生医療等製品の承認を目的として臨床研究を実施するアカデミアや、医師主導治験を実施する医療機関、再生医療等製品の開発を行っている企業を対象に、再生医療等製品に特化した開発製造受託(CDMO)サービス・開発業務受託(CRO)サービスを提供しております。自社製品の開発、製造販売で培った薬事開発、規制当局対応のノウハウ、GCTP適合の製造設備等の豊富な実績及びノウハウを生かし、細胞種(体細胞・幹細胞・iPS細胞)や製品形態を問わず、シーズの開発段階から実用化後までトータルかつシームレスに支援しております。
さらに、2014年11月に施行された再生医療等安全性確保法に則った、再生医療の提供機関に対するコンサルティングならびに特定細胞加工物製造受託サービスを提供しております。コンサルティングサービスでは、再生医療等提供計画の作成・細胞加工施設の運営体制の構築等、臨床研究・治療提供のために必要な行政手続きを支援しております。特定細胞加工物製造受託では、厚生労働省より許可を得た当社の細胞加工施設で特定細胞加工物の製造を受託しております。
(4)研究開発支援事業
種々の医薬品や化粧品の開発に際して、開発製品の安全性や有効性を確認する等の目的により、動物を用いた試験が実施されております。
当社は再生医療等製品の開発を通じて蓄積したティッシュエンジニアリングに係る技術、ノウハウを水平展開し、研究用ヒト培養組織ラボサイトシリーズを開発、製造、販売しております。ラボサイトは、「エピ・モデル」「角膜モデル」「エピ・キット」の3つの製品ラインアップを揃えております。
「エピ・モデル」はヒトの正常な表皮細胞を培養して重層化したヒト3次元表皮モデルであり、ヒト表皮に類似した構造をしております。ヒトの皮膚に適用される外用医薬品や化粧品の開発、皮膚科医の基礎研究、化成品原材料の安全性研究等に有用な材料であると同時に、動物を使った皮膚試験の代替としての使用が想定されます。なお、「エピ・モデル」を用いた皮膚刺激性試験に関する試験法は、2013年7月に経済協力開発機構(OECD)の試験法ガイドラインTG439へ収載され、「エピ・モデル24」を含む皮膚腐食性試験法は、2019年6月にOECDの試験法ガイドラインTG431へ収載されました。
「角膜モデル」はヒト正常角膜上皮細胞を重層培養したヒト3次元角膜モデルです。角膜モデルでは、ムチン等のタンパク質の発現や細胞間接着構造等を確認しており、化合物の眼刺激性試験に加えて、角膜上皮の分子生物学的解析に利用できます。「角膜モデル」を用いた眼刺激性試験法については、2018年6月にOECDの試験法ガイドラインTG492へ収載されました。
「エピ・キット」は顧客自身でヒト表皮モデルを作製できるヒト3次元表皮モデルの作製キットです。ヒト表皮モデルへの評価物質の添加やモデルの解析等を自由に設定できます。また、予め細胞に処理を行ったヒト表皮モデルの作製・解析等応用研究に使用できます。
(5)新規パイプラインの開発
当社は、今後の成長を加速させるため、新たなパイプラインの開発に積極的に取り組んでおります。
①メラノサイト含有自家培養表皮(販売名:ジャスミン)の開発
非外科的治療が無効又は適応とならない白斑の治療を目的とする、メラノサイト(色素細胞)含有自家培養表皮(販売名:ジャスミン)については、2023年3月17日付で製造販売承認を取得しました。今後、速やかに保険適用を目指すとともに、患者の生活の質(QOL)向上に貢献します。
②他家(同種)培養表皮(開発名:Allo-JaCE03)の開発
わが国で初となる他人の皮膚を原材料としたレディメイド(事前に製造・保存しておき、必要な時に遅滞なく使用することができる)製品である他家(同種)培養表皮(開発名:Allo-JaCE03)については、2021年8月に日本医療研究開発機構(AMED)の補助事業として「同種培養表皮の開発・事業化」に関する案件が採択され、2021年11月に治験計画届書を提出しました。さらに、「再生医療等製品の原材料となるヒト(同種)細胞の安定供給体制の構築」に関する案件が2021年6月にAMEDの委託事業として採択されており、他家(同種)細胞を用いた再生医療の産業化を進めております。
③CAR-T細胞製剤の開発
CD19陽性の急性リンパ性白血病(Acute Lymphoblastic Leukemia, ALL)を対象とした自家CAR-T細胞製剤について、2019年9月より「piggyBacトランスポゾンベクターを用いた自家CD19CAR-T療法の企業治験開始に向けた研究開発」(ウイルスベクターを用いない新技術による国産のCAR-T細胞製剤の開発)に関するAMEDの補助事業として開発を進めてきました。並行して、技術導入元である名古屋大学において同技術を用いた急性リンパ性白血病に対する臨床研究が実施されるとともに、自社の製造工程の効率化を図りました。また、同大学が支援しているタイ王国チュラロンコン大学のCAR-T細胞を用いた臨床研究についても、2023年3月、悪性リンパ腫を患う5名の患者の治療に効果があったことが報告されました。さらに、今後、名古屋大学でも日本での悪性リンパ腫に対するCAR-T細胞を用いた医師主導治験の開始を予定していることも合わせて報告され、日本での医師主導治験に用いられるCAR-T細胞は、当社が製造する予定です。これに加え、当社は本品の開発で得た知見やノウハウを生かし、柏の葉スマートシティ内に構築する「再生医療プラットフォーム」において帝人、国立研究開発法人国立がん研究センター、三井不動産株式会社と協働し、がん領域における本格的な事業展開に繋げていきます。
ジャパン・ティッシュ・エンジニアリングの平均年収は583万円
生涯収入の全国平均である約1.9億円に対し、ジャパン・ティッシュ・エンジニアリングの生涯収入はおよそ2.16億円と推定されます。
| 年 | 平均年収 |
|---|---|
| 2013 | 515万円 |
| 2014 | 530万円 |
| 2015 | 523万円 |
| 2016 | 520万円 |
| 2017 | 546万円 |
| 2018 | 548万円 |
| 2019 | 577万円 |
| 2020 | 559万円 |
| 2021 | 575万円 |
| 2022 | 583万円 |
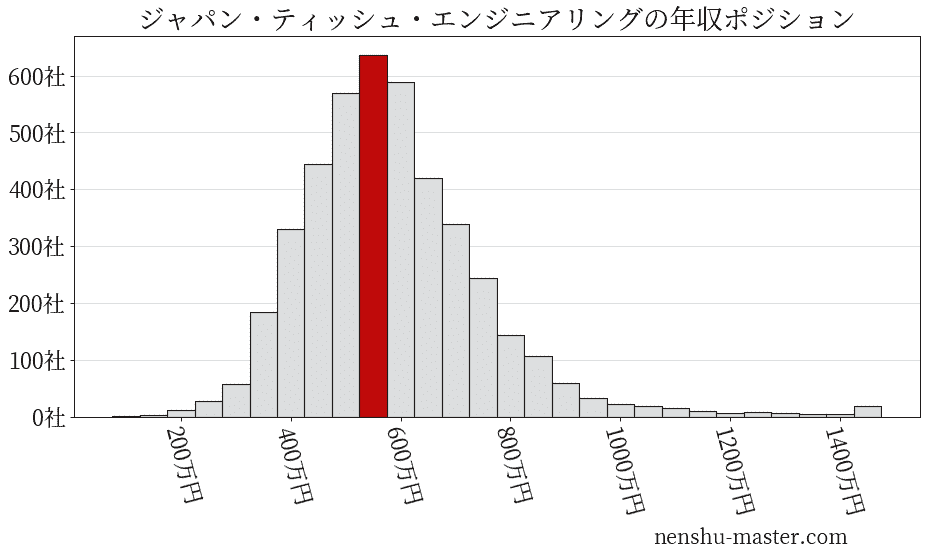
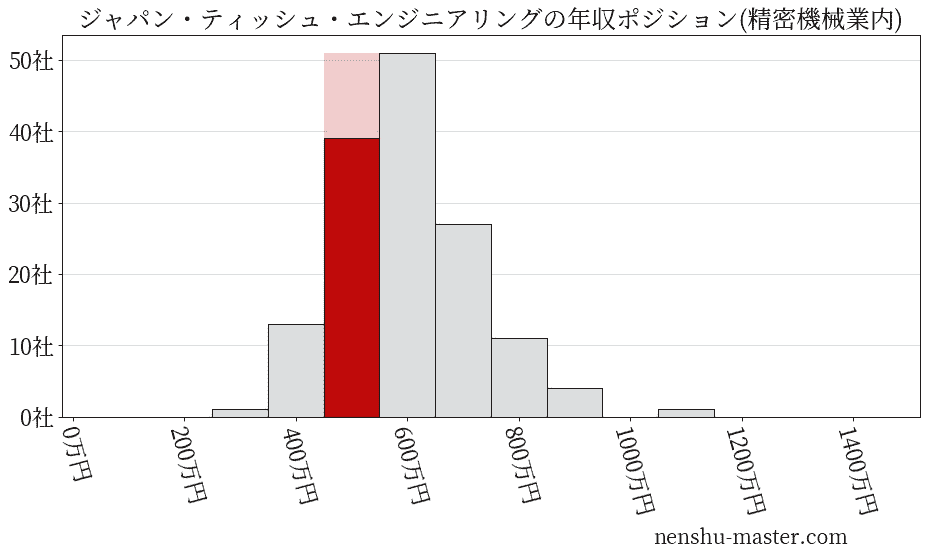
平均年収と社数のヒストグラム上ではジャパン・ティッシュ・エンジニアリングは赤色の箇所に位置しています。 年収ランキングではジャパン・ティッシュ・エンジニアリングは2632位(全4687社)で、年収偏差値は55.7でした。
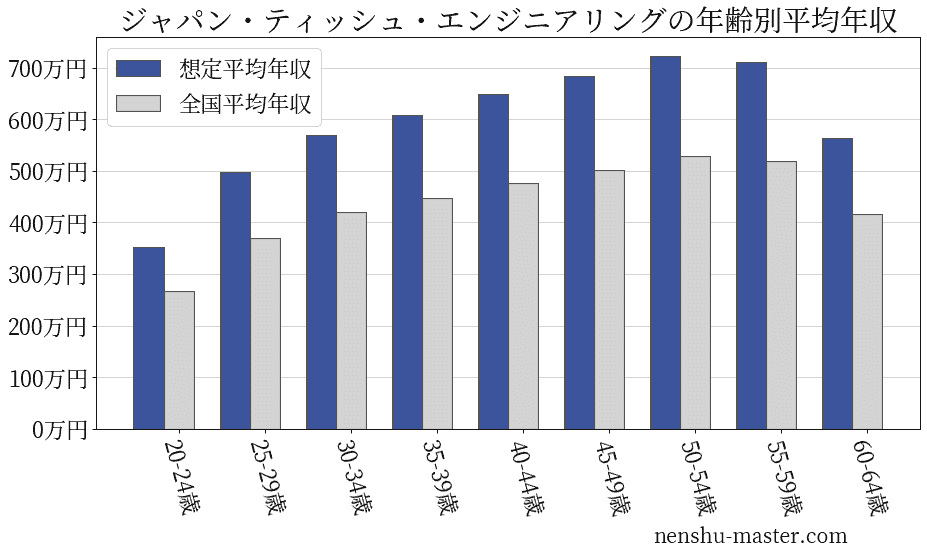
ジャパン・ティッシュ・エンジニアリングの年齢別年収
| 年齢 | 想定平均年収 | 月額給与 |
|---|---|---|
| 20-24歳 | 353万円 | 27万円 |
| 25-29歳 | 499万円 | 38万円 |
| 30-34歳 | 569万円 | 44万円 |
| 35-39歳 | 609万円 | 47万円 |
| 40-44歳 | 648万円 | 50万円 |
| 45-49歳 | 685万円 | 53万円 |
| 50-54歳 | 723万円 | 56万円 |
| 55-59歳 | 710万円 | 55万円 |
| 60-64歳 | 563万円 | 43万円 |
ジャパン・ティッシュ・エンジニアリングの賞与・ボーナス
| 年 | 平均賞与額 |
|---|---|
| 2013 | 45万円 |
| 2014 | 45万円 |
| 2015 | 43万円 |
| 2016 | 47万円 |
| 2017 | 49万円 |
| 2018 | 64万円 |
| 2019 | 69万円 |
| 2020 | 67万円 |
| 2021 | 61万円 |
| 2022 | 59万円 |
ジャパン・ティッシュ・エンジニアリングの業種・地域
※こちらは、実際の企業数とは大きく異なる点に注意してください。多くの企業が本社所在地を東京にしているため、それ以外の地域では企業数が少なくなります。
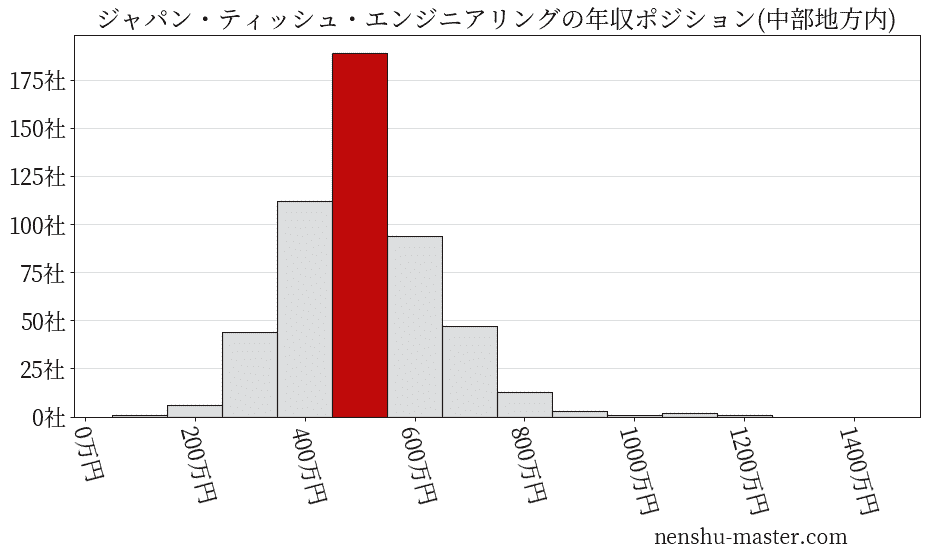
精密機械業内での年収ランキング
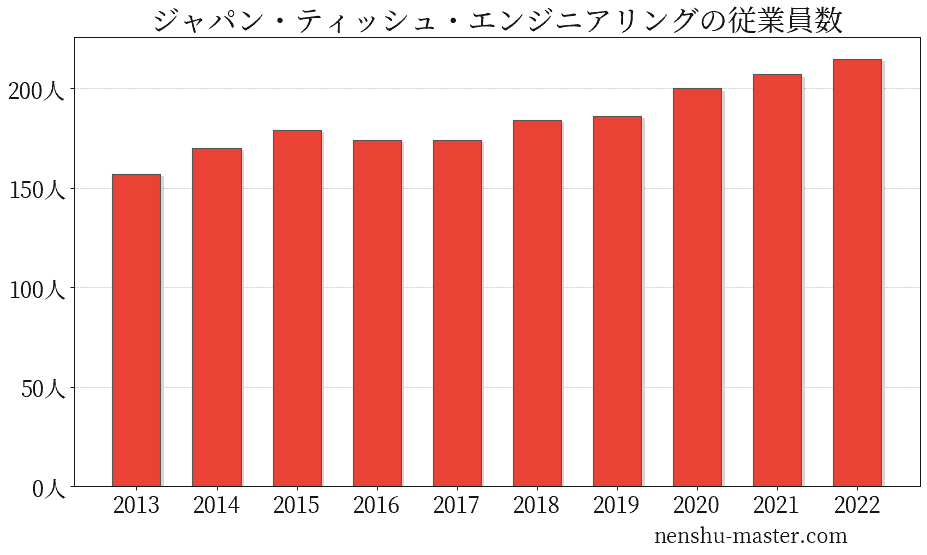
ジャパン・ティッシュ・エンジニアリングの従業員数は215人
| 年 | 従業員数 |
|---|---|
| 2013 | 157人 |
| 2014 | 170人 |
| 2015 | 179人 |
| 2016 | 174人 |
| 2017 | 174人 |
| 2018 | 184人 |
| 2019 | 186人 |
| 2020 | 200人 |
| 2021 | 207人 |
| 2022 | 215人 |
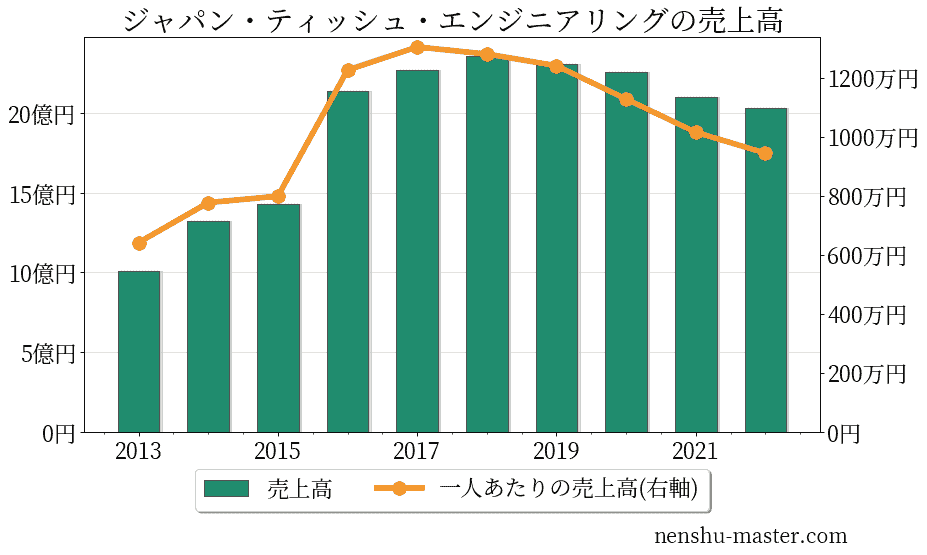
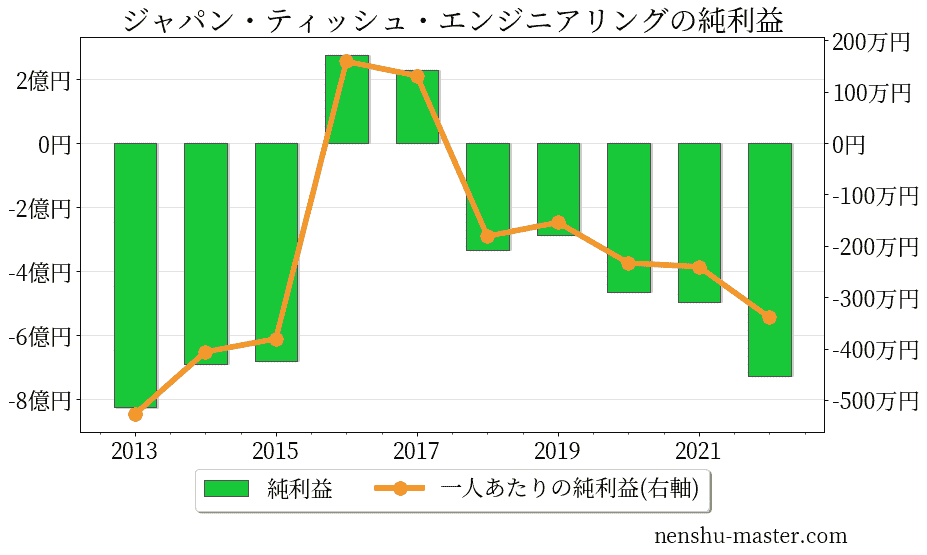
ジャパン・ティッシュ・エンジニアリングの売上、純利益
【広告】ジャパン・ティッシュ・エンジニアリングに転職するには?
転職サイトはサイトごとに特色があり、2〜3サイトを登録してそれぞれの良い部分を利用するのが賢い利用方法です。年収マスターイチオシのサイトを紹介します。
JACリクルートメント
「JACリクルートメント」はハイクラスな転職案件を多数持っており、市場価値の高い応募者におすすめのサイトです。 内資系の高額案件はもちろん、JACリクルートメントはイギリスやシンガポールでも展開しており、そのつながりを活かした外資系案件も多数あります。
他の転職サイトでは一気に大量の案件を提示されることがありどれを選べばわからないということが起こりますが、JACリクルートメントではそのようなことはありません。 ひとりの応募者につき複数のエージェントが担当し、選りすぐりの案件を紹介してくれるためマッチ度が高い仕事に出会えます。
ハイクラス案件をメインで扱うJACリクルートメントのみでしか得られない案件情報も多数あります。 上昇志向があり、現在のポジションからステップアップしてよりハイキャリアを目指す方にはイチオシのサイトです。
ランスタッド
「ランスタッド」は敏腕コンサルタントが専任で案件紹介をしてくれる転職サイトです。 ランスタッドのエージェントは評判が良く、最近人気が大きく伸びてきてきています。 よくある転職サイトはエージェントが十分なヒアリングも無くノルマ達成のためにたくさんの案件を紹介してきますが、 ランスタッドはそのようなことはありません。
ランスタッドは少数精鋭のコンサルタントで運営されており、現状のスキルや今後構築したいキャリアなどを入念にヒアリングした上で案件紹介をしてくれます。 特に20代後半から30代の転職に力を入れており、応募者にマッチした案件を紹介してくれます。
そのため案件の質も高く、JACリクルートメントと同様に高年収案件に強い印象です。800万円や1200万円を超える案件も多数あり、 ハイキャリアを目指す方には心強いパートナーです。ランスタッドのみでしか公開されてない案件もかなり多いので、 一度無料登録して相談してみることをオススメします。
参考書籍
ジャパン・ティッシュ・エンジニアリングの歴史
| 1999年 2月 | 株式会社ニデック、株式会社INAX、富山化学工業株式会社(現 富士フイルム富山化学株式会社)ならびに株式会社セントラル・キャピタルとの共同出資により、ティッシュエンジニアリングを技術ベースに再生医療を事業領域とする企業として愛知県蒲郡市に当社を設立。 |
| 2003年 8月 | イタリアの角膜バンクであるベネトアイバンクから技術を導入し、培養角膜上皮の研究開発を開始。 |
| 2003年 9月 | 東京女子医科大学病院等の施設において治験審査委員会の承認を受け、自家培養表皮の治験を開始。 |
| 2004年 5月 | 広島大学病院等の施設において治験審査委員会の承認を受け、自家培養軟骨の治験を開始。 |
| 2005年 3月 | 研究用ヒト培養組織LabCyte EPI-MODEL(ラボサイト エピ・モデル)の販売を開始。 |
| 2007年 12月 | ジャスダック証券取引所NEOへ株式を上場。 |
| 2010年 7月 | 研究用ヒト培養組織LabCyte CORNEA-MODEL(ラボサイト 角膜モデル)の販売を開始。 |
| 2012年 5月 | 表皮水疱症の治療を目的とした自家培養表皮ジェイスの治験を開始。 |
| 2014年 1月 | 先天性巨大色素性母斑の治療を目的とした自家培養表皮ジェイスの治験を開始。 |
| 2014年 10月 | 角膜上皮幹細胞疲弊症の治療を目的とした自家培養角膜上皮の治験を開始。 |
| 2014年 11月 | 新規事業として、再生医療等安全性確保法のコンサルティング事業ならびに細胞培養受託事業を開始。 |
| 2016年 4月 | 新規事業として、再生医療等製品に特化したCRO事業を開始。 |
| 2018年 7月 | 白斑の治療を目的としたメラノサイトを保持した自家培養表皮の治験を開始。 |
| 2018年 7月 | 外傷等に起因する二次性の変形性膝関節症の治療を目的とした自家培養軟骨ジャックの治験を開始。 |
| 2019年 9月 | 富士フイルムのヒトiPS細胞由来腸管上皮細胞「F-hiSIEC™」について、製造及び販売を開始。 |
| 2021年 11月 | Ⅱ度熱傷の治療を目的とした他家培養表皮の治験を開始。 |
| 2022年 4月 | 東京証券取引所の市場区分の見直しにより、東京証券取引所のJASDAQグロースからグロース市場に移行。 |
ジャパン・ティッシュ・エンジニアリングの子会社
| 名称 | 事業内容 |
|---|---|
| (親会社) 帝人株式会社 | 合成繊維、化成品等の研究、製造、販売他 |
ジャパン・ティッシュ・エンジニアリングの類似企業
ジャパン・ティッシュ・エンジニアリングと平均年収が近い企業
ジャパン・ティッシュ・エンジニアリングと売上高が近い企業
| 企業名 | 売上高 |
|---|---|
| エイトレッド | 21.7億円 |
| コシダカHD | 20.3億円 |
| K&Oエナジーグループ | 21.0億円 |
| 人・夢・技術グループ | 21.5億円 |
| インサイト | 19.2億円 |
| ステムセル研究所 | 20.9億円 |
| エーワン精密 | 18.7億円 |
| 豊橋鉄道 | 20.0億円 |
| エルテス | 20.6億円 |
| 市進HD | 21.4億円 |
